توجه این مطلب فقط برای افزایش اطلاعات درباره ی این بیماری است
بيماري ام اس
بيماري ام.اس (موليتپل اسكلروزيس) يكي از شايعترين بيماريهاي سيستم اعصاب مركزي (مغز و نخاع) مي باشد. اين بيماري در اثر تخريب غلاف ميلين ايجاد مي شود. ميلين غلافي است كه فيبرهاي عصبي را احاطه مي كند و در انتقال سريع امواج عصبي نقش بسيار مهمي دارد.
در حالت طبيعي با وجود اين غلاف امواج عصبي سريع منتقل شده و حركات موزون و هماهنگ بدن حاصل ميشود.
در بيماري ام.اس اين غلاف عصبي تخريب مي شود. بدين ترتيب امواج عصبي از مغز به خوبي منتقل نمي شود و علايم مختلف بيماري ام.اس ظاهر مي شود.
در مناطقي كه ميلين تخريب شده است پلاك هايي ظاهر مي شود.
چه كساني به بيماري ام.اس مبتلا مي شوند؟
خانمها بيشتر از آقايان در معرض اين بيماري هستند به طوريكه نسبت ابتلا زنان به مردان به ميزان ۳ به ۲ مي باشد. بيماري ام.اس بيماري افراد جوان است به طوريكه متوسط شروع بيماري بين ۳۳-۲۹ سالگي است. از طرفي ممكن است اين بيماري افراد را از ۱۰ تا ۵۹ سالگي درگير كند.
نکات سريع
- بيماري ام اس يک بيماري پيش رونده سيستم عصبي است که هنوز درمان قطعي براي آن پيدا نشده است.
- حدود ۵/۲ ميليون نفر بيمار مبتلا به ام اس در سراسر جهان وجود دارد.
- زنان بيشتر از مردان گرفتار مي شوند.
- بيماري ام اس شايعترين بيماري سيستم اعصاب مرکزي در افراد جوان است.
- چهار نوع بيماري ام اس وجود دارد : خوش خيم ، بدخيم ، عودکننده –فروکش کننده ، پيش رونده ، پيش رونده اوليه.
- در بيماري ام اس ميلين احاطه کننده فيبرهاي عصبي تخريب مي شود.
- با اينکه علت دقيق بيماري ام اس نامشخص است اما محتمل ترين علت آن تخريب غلاف ميلين در اثر يک فرآيند التهابي خودايمني است .
- بيماري ام اس يک بيماري ارثي نمي باشد اما نقش ژنتيک در آن بخوبي شناخته شده است.
- بيماري عصبي ام اس مسري نمي باشد.
- بيماران مبتلا معمولا در سنين ۲۰ تا ۴۰ سالگي تشخيص داده مي شوند .
- به ندرت اين بيماري در افراد زير ۱۲ سال و بالاي ۵۵ سال ديده مي شود.
- بيماران مبتلا ، علايم بسيار متفاوتي دارند.
- هيچ درمان قطعي براي اين بيماري وجود ندارد اما درمانهاي موجود در تغيير روند بيماري مؤثر هستند.
علت بيماري ام.اس
علت دقيق اين بيماري هنوز شناخته نشده است. مطالعات وسيعي در اين زمينه در سراسر دنيا در حال انجام است.
تخريب غلاف ميلين احتمالاٌ در اثر پاسخ غير طبيعي سيستم ايمني بدن مي باشد. علت اين عملكرد غير طبيعي سيستم ايمني هنوز به خوبي شناخته نشده است. احتمالاًٌ چندين عامل مختلف در اين روند دخالت دارد كه عبارتند از : عفونت ، ژنتيك ، استرس ، نقص ايمني و عوامل محيطي.
انواع بيماري ام.اس
سير بيماري ام.اس غير قابل پيش بيني است. برخي از بيماران سير خوش خيمي دارند ، در حاليكه برخي از بيماران ديگر سير سريعاٌ پيش رونده دارند كه منجر به ناتواني آنها مي شود. اكثر بيماران مبتلا به ام.اس در بين اين دو طيف قرار دارند. با اينكه بيماران مختلف علايم بسيار متفاوتي دارند اما به طور كلي با توجه به سير بيماري ، اين بيماري چهار نوع مختلف دارد :
۱- ام.اس پيش رونده –فروكش كننده :
در اين نوع ام.اس ، حمله هاي غير قابل پيش بيني ظاهر مي شوند. حملات ممكن است به صورت ظاهر شدن علايم جديد يا تشديد علايم قبلي باشد.طول مدت حملات متغير است. (روزها يا ماهها) و بهبودي كامل يا نسبي ديده مي شود. بعد از اين حملات بيماري به مدت چندين ماه يا چندين سال خاموش است.
۲- ام.اس خوش خيم :
در اين نوع ام.اس ، يك يا دوحمله با بهبودي كامل ديده مي شود.باگذشت زمان در اين نوع ام.اس سير پيش رونده يا ناتواني دائمي ديده نمي شود. بيماري ام.اس زماني در اين دسته قرار مي گيرد كه بيمار بعد از ۱۰ تا ۱۵ سال از حمله اول ، ناتواني بسيار اندكي داشته باشد. با توجه به حملات اوليه، ممكن است اين نوع ام.اس ابتدا در دسته عود كننده – فروكش كننده قرارگيرد.
۳- ام.اس پيش رونده ثانويه :
در برخي از بيماران مبتلا به نوع عود كننده – فروكش كننده ، احتمال ايجاد ناتواني پيش رونده وجود دارد. ناتواني اغلب به دنبال حملات رخ مي دهد.
۴- ام.اس پيش رونده اوليه :
در اين نوع ام.اس حملات واضحي وجود ندارد. بيماري به تدريج شروع شده و به آرامي پيشرفت مي كند.
علايم بيماري ام.اس
علايم بيماري ام.اس بسيار متغير است. اين علايم بسته به اينكه چه منطقه اي از سيستم اعصاب مركزي گرفتار شده ، متفاوت است. الگوي بيماري ام.اس از هر فردي به فرد ديگري متفاوت است. اين علايم حتي در يك فرد خاص در طول سير بيماري تغيير مي كند.
علايم شايع اين بيماري شامل :
۱- اختلالات بينايي : تاري ديد ، دو بيني ، اپتيك نوريت ، حركات غير ارادي و سريع چشم و به ندرت از دست دادن كامل بينايي.
۲- اختلالات تعادل : لرزش ، عدم تعادل در راه رفتن ، سرگيجه ، ضعف و كرختي اندامها ، اختلال در انجام حركات موزون.
۳- سفتي عضلات
۴- اختلالات حسي : گزگز و مور مور ، احساس سوزش ،بي حسي و درد.
۵- اختلالات تكلم : صحبت كردن آهسته ، تغيير حالت تكلم ، كشيدن كلمات و اختلال بلع .
۶- خستگي
۷- مشكلات مثانه و اختلال در اجابت مزاج:
- اختلالات مثانه شامل : تكرر ادرار ، فوريت در ادرار كردن، دفع ناقص مثانه يا دفع غير ارادي.
- اختلالات اجابت مزاج شامل : يبوست و به ندرت بي اختياري.
۸- مشكلات جنسي : ناباروري ، كم شدن ميل جنسي.
۹- حساسيت به گرما : گرما در بسياري از موارد باعث تشديد علايم مي شود.
۱۰- اختلالات شناختي : اختلال در حافظه كوتاه مدت ، اختلال در تمركز و قدرت تصميم گيري.
بايد توجه داشت كه برخي از اين علايم واضح هستند ولي برخي ديگر از علايم مثل خستگي ، اختلالات حافظه و تمركز براي اطرافيان آشكار و قابل درك نمي باشد
سير بيماري ام.اس
سير بيماري در افراد مختلف متفاوت است . بايد توجه داشت كه درصد بالايي از بيماران مبتلا به ام.اس زندگي كاملاٌ طبيعي را دنبال مي كنند
تشخيص بيماري ام.اس
در حال حاضر ام . آر . آي دقيق ترين روش براي تشخيص بيماري ام.اس مي باشد. بايد توجه داشت كه ساير بيماريها هم مي توانند علايم بيماري ام.اس را تقليد كنند.
هيچ تست آزمايشگاهي، علامت يا يافته كلينيكي واحدي براي تشخيص بيماري ام.اس وجود ندارد.
درمانهاي موجود براي بيماران مبتلاء به ام . اس
بااينكه درمان قطعي براي بيماري ام . اس وجود ندارد ، اما برخي داروها جهت بهبود علايم و سير بيماري شناخته شده است :
داروهايي كه سير بيماري را تغيير مي دهند :
*
Glatiramer acetate ( Copaxone s® )
*
Interferon beta-1a ( Avonex ® )
*
Interferon beta-1a ( Rebif ® )
*
Interferon beta-1b ( Betaseron ® or Betaferon ® )
*
Mitoxantrone ( Novantrone ® )
داروهايي كه جهت بهبود حملات حاد بيماري استفاده مي شود :
*
Dexamethasone ( Decadron ® )
*
Methylprednisolone ( Depo-Medrol ® )
*
Prednisone ( Deltasone ® )
درمانهاي علامتي بيماري :
گرفتگي عضلات :
*
Baclofen ( Lioresal ® )
*
Clonazepam ( Klonopin ® or Rivotril ® )
*
Dantrolene ( Dantrium ® )
*
Diazepam ( Valium ® )
*
Gabapentin ( Neurontin ® )
*
Tizanidine ( Zanaflex ® )
لرزش :
*
Clonazepam ( Klonopin ® or Rivotril ® )
*
Isoniazid ( Laniazid ® )
خستگي :
*
Amantadine
*
Fluoxetine ( Prozac ® )
*
Modafinil ( Provigil ® )
*
Pemoline ( Cylert ® )
اختلالات عملكرد مثانه :
*
Ciprofloxacin ( Cipro ® )
*
Desmopressin ( DDAVP Nasal Spray ® )
*
Imipramine ( Tofranil ® )
*
Methenamine ( Hiprex , Mandelamine ® )
*
Nitrofurantoin ( Macrodantin ® )
*
Oxybutynin ( Ditropan ® )
*
Oxybutynin : extended release formula ( Ditropan ® )
*
Phenazopyridine ( Pyridium ® )
*
Propantheline bromide ( Pro-Banthine ® )
*
Sulfamethoxazole ( Bactrim® or Septra ® )
*
Tolterodine ( Detrol ® )
اختلالات عملكرد روده :
*
Bisacodyl ( Dulcolax ® )
*
Docusate ( Colace ® )
*
Docusate mini enema ( Therevac Plus ® )
*
Glycerin ( Sani-Supp supository ® )
*
Magnesium hydroxide ( Phillips Milk of Magnesia ® )
*
Mineral oil
*
Psyllium hydrophilic mucilloid1 ( Metamucil ® )
*
Sodium phosphate ( Fleet Enema ® )
اختلالات جنسي :
*
Alprostadil ( Prostin VR ® )
*
Alprostadil ( MUSE ® )
*
Papaverine
*
Sildenafil ( Viagra ® )
درد :
*
Amitriptyline ( Elavil ® )
*
Carbamazepine ( Tegretol ® )
*
Clonazepam ( Klonopin® or Rivotril ® )
*
Gabapentin ( Neurontin ® )
*
Imipramine ( Tofranil ® )
*
Nortriptyline ( Pamelor® or Aventyl ® )
*
Phenytoin ( Dilantin ® )
اختلالات روحي ، رواني و شناختي :
*
Bupropion ( Wellbutrin ® )
*
Fluoxetine ( Prozac ® )
*
Paroxetine ( Paxil ® )
*
Sertraline ( Zoloft ® )
*
Venlafaxine ( Effexor ® )
سرگيجه :
*
Meclizine ( Antivert ® or Bonamine ® )
حساسيت به گرما و خارش متناوب :
*
Hydroxyzine ( Atarax ® )
تهوع و استفراغ :
*
Meclizine ( Antivert ® or Bonamine ® )
بيماري ام.اس (موليتپل اسكلروزيس) يكي از شايعترين بيماريهاي سيستم اعصاب مركزي (مغز و نخاع) مي باشد. اين بيماري در اثر تخريب غلاف ميلين ايجاد مي شود. ميلين غلافي است كه فيبرهاي عصبي را احاطه مي كند و در انتقال سريع امواج عصبي نقش بسيار مهمي دارد.
در حالت طبيعي با وجود اين غلاف امواج عصبي سريع منتقل شده و حركات موزون و هماهنگ بدن حاصل ميشود.
در بيماري ام.اس اين غلاف عصبي تخريب مي شود. بدين ترتيب امواج عصبي از مغز به خوبي منتقل نمي شود و علايم مختلف بيماري ام.اس ظاهر مي شود.
در مناطقي كه ميلين تخريب شده است پلاك هايي ظاهر مي شود.
چه كساني به بيماري ام.اس مبتلا مي شوند؟
خانمها بيشتر از آقايان در معرض اين بيماري هستند به طوريكه نسبت ابتلا زنان به مردان به ميزان ۳ به ۲ مي باشد. بيماري ام.اس بيماري افراد جوان است به طوريكه متوسط شروع بيماري بين ۳۳-۲۹ سالگي است. از طرفي ممكن است اين بيماري افراد را از ۱۰ تا ۵۹ سالگي درگير كند.
نکات سريع
- بيماري ام اس يک بيماري پيش رونده سيستم عصبي است که هنوز درمان قطعي براي آن پيدا نشده است.
- حدود ۵/۲ ميليون نفر بيمار مبتلا به ام اس در سراسر جهان وجود دارد.
- زنان بيشتر از مردان گرفتار مي شوند.
- بيماري ام اس شايعترين بيماري سيستم اعصاب مرکزي در افراد جوان است.
- چهار نوع بيماري ام اس وجود دارد : خوش خيم ، بدخيم ، عودکننده –فروکش کننده ، پيش رونده ، پيش رونده اوليه.
- در بيماري ام اس ميلين احاطه کننده فيبرهاي عصبي تخريب مي شود.
- با اينکه علت دقيق بيماري ام اس نامشخص است اما محتمل ترين علت آن تخريب غلاف ميلين در اثر يک فرآيند التهابي خودايمني است .
- بيماري ام اس يک بيماري ارثي نمي باشد اما نقش ژنتيک در آن بخوبي شناخته شده است.
- بيماري عصبي ام اس مسري نمي باشد.
- بيماران مبتلا معمولا در سنين ۲۰ تا ۴۰ سالگي تشخيص داده مي شوند .
- به ندرت اين بيماري در افراد زير ۱۲ سال و بالاي ۵۵ سال ديده مي شود.
- بيماران مبتلا ، علايم بسيار متفاوتي دارند.
- هيچ درمان قطعي براي اين بيماري وجود ندارد اما درمانهاي موجود در تغيير روند بيماري مؤثر هستند.
علت بيماري ام.اس
علت دقيق اين بيماري هنوز شناخته نشده است. مطالعات وسيعي در اين زمينه در سراسر دنيا در حال انجام است.
تخريب غلاف ميلين احتمالاٌ در اثر پاسخ غير طبيعي سيستم ايمني بدن مي باشد. علت اين عملكرد غير طبيعي سيستم ايمني هنوز به خوبي شناخته نشده است. احتمالاًٌ چندين عامل مختلف در اين روند دخالت دارد كه عبارتند از : عفونت ، ژنتيك ، استرس ، نقص ايمني و عوامل محيطي.
انواع بيماري ام.اس
سير بيماري ام.اس غير قابل پيش بيني است. برخي از بيماران سير خوش خيمي دارند ، در حاليكه برخي از بيماران ديگر سير سريعاٌ پيش رونده دارند كه منجر به ناتواني آنها مي شود. اكثر بيماران مبتلا به ام.اس در بين اين دو طيف قرار دارند. با اينكه بيماران مختلف علايم بسيار متفاوتي دارند اما به طور كلي با توجه به سير بيماري ، اين بيماري چهار نوع مختلف دارد :
۱- ام.اس پيش رونده –فروكش كننده :
در اين نوع ام.اس ، حمله هاي غير قابل پيش بيني ظاهر مي شوند. حملات ممكن است به صورت ظاهر شدن علايم جديد يا تشديد علايم قبلي باشد.طول مدت حملات متغير است. (روزها يا ماهها) و بهبودي كامل يا نسبي ديده مي شود. بعد از اين حملات بيماري به مدت چندين ماه يا چندين سال خاموش است.
۲- ام.اس خوش خيم :
در اين نوع ام.اس ، يك يا دوحمله با بهبودي كامل ديده مي شود.باگذشت زمان در اين نوع ام.اس سير پيش رونده يا ناتواني دائمي ديده نمي شود. بيماري ام.اس زماني در اين دسته قرار مي گيرد كه بيمار بعد از ۱۰ تا ۱۵ سال از حمله اول ، ناتواني بسيار اندكي داشته باشد. با توجه به حملات اوليه، ممكن است اين نوع ام.اس ابتدا در دسته عود كننده – فروكش كننده قرارگيرد.
۳- ام.اس پيش رونده ثانويه :
در برخي از بيماران مبتلا به نوع عود كننده – فروكش كننده ، احتمال ايجاد ناتواني پيش رونده وجود دارد. ناتواني اغلب به دنبال حملات رخ مي دهد.
۴- ام.اس پيش رونده اوليه :
در اين نوع ام.اس حملات واضحي وجود ندارد. بيماري به تدريج شروع شده و به آرامي پيشرفت مي كند.
علايم بيماري ام.اس
علايم بيماري ام.اس بسيار متغير است. اين علايم بسته به اينكه چه منطقه اي از سيستم اعصاب مركزي گرفتار شده ، متفاوت است. الگوي بيماري ام.اس از هر فردي به فرد ديگري متفاوت است. اين علايم حتي در يك فرد خاص در طول سير بيماري تغيير مي كند.
علايم شايع اين بيماري شامل :
۱- اختلالات بينايي : تاري ديد ، دو بيني ، اپتيك نوريت ، حركات غير ارادي و سريع چشم و به ندرت از دست دادن كامل بينايي.
۲- اختلالات تعادل : لرزش ، عدم تعادل در راه رفتن ، سرگيجه ، ضعف و كرختي اندامها ، اختلال در انجام حركات موزون.
۳- سفتي عضلات
۴- اختلالات حسي : گزگز و مور مور ، احساس سوزش ،بي حسي و درد.
۵- اختلالات تكلم : صحبت كردن آهسته ، تغيير حالت تكلم ، كشيدن كلمات و اختلال بلع .
۶- خستگي
۷- مشكلات مثانه و اختلال در اجابت مزاج:
- اختلالات مثانه شامل : تكرر ادرار ، فوريت در ادرار كردن، دفع ناقص مثانه يا دفع غير ارادي.
- اختلالات اجابت مزاج شامل : يبوست و به ندرت بي اختياري.
۸- مشكلات جنسي : ناباروري ، كم شدن ميل جنسي.
۹- حساسيت به گرما : گرما در بسياري از موارد باعث تشديد علايم مي شود.
۱۰- اختلالات شناختي : اختلال در حافظه كوتاه مدت ، اختلال در تمركز و قدرت تصميم گيري.
بايد توجه داشت كه برخي از اين علايم واضح هستند ولي برخي ديگر از علايم مثل خستگي ، اختلالات حافظه و تمركز براي اطرافيان آشكار و قابل درك نمي باشد
سير بيماري ام.اس
سير بيماري در افراد مختلف متفاوت است . بايد توجه داشت كه درصد بالايي از بيماران مبتلا به ام.اس زندگي كاملاٌ طبيعي را دنبال مي كنند
تشخيص بيماري ام.اس
در حال حاضر ام . آر . آي دقيق ترين روش براي تشخيص بيماري ام.اس مي باشد. بايد توجه داشت كه ساير بيماريها هم مي توانند علايم بيماري ام.اس را تقليد كنند.
هيچ تست آزمايشگاهي، علامت يا يافته كلينيكي واحدي براي تشخيص بيماري ام.اس وجود ندارد.
درمانهاي موجود براي بيماران مبتلاء به ام . اس
بااينكه درمان قطعي براي بيماري ام . اس وجود ندارد ، اما برخي داروها جهت بهبود علايم و سير بيماري شناخته شده است :
داروهايي كه سير بيماري را تغيير مي دهند :
*
Glatiramer acetate ( Copaxone s® )
*
Interferon beta-1a ( Avonex ® )
*
Interferon beta-1a ( Rebif ® )
*
Interferon beta-1b ( Betaseron ® or Betaferon ® )
*
Mitoxantrone ( Novantrone ® )
داروهايي كه جهت بهبود حملات حاد بيماري استفاده مي شود :
*
Dexamethasone ( Decadron ® )
*
Methylprednisolone ( Depo-Medrol ® )
*
Prednisone ( Deltasone ® )
درمانهاي علامتي بيماري :
گرفتگي عضلات :
*
Baclofen ( Lioresal ® )
*
Clonazepam ( Klonopin ® or Rivotril ® )
*
Dantrolene ( Dantrium ® )
*
Diazepam ( Valium ® )
*
Gabapentin ( Neurontin ® )
*
Tizanidine ( Zanaflex ® )
لرزش :
*
Clonazepam ( Klonopin ® or Rivotril ® )
*
Isoniazid ( Laniazid ® )
خستگي :
*
Amantadine
*
Fluoxetine ( Prozac ® )
*
Modafinil ( Provigil ® )
*
Pemoline ( Cylert ® )
اختلالات عملكرد مثانه :
*
Ciprofloxacin ( Cipro ® )
*
Desmopressin ( DDAVP Nasal Spray ® )
*
Imipramine ( Tofranil ® )
*
Methenamine ( Hiprex , Mandelamine ® )
*
Nitrofurantoin ( Macrodantin ® )
*
Oxybutynin ( Ditropan ® )
*
Oxybutynin : extended release formula ( Ditropan ® )
*
Phenazopyridine ( Pyridium ® )
*
Propantheline bromide ( Pro-Banthine ® )
*
Sulfamethoxazole ( Bactrim® or Septra ® )
*
Tolterodine ( Detrol ® )
اختلالات عملكرد روده :
*
Bisacodyl ( Dulcolax ® )
*
Docusate ( Colace ® )
*
Docusate mini enema ( Therevac Plus ® )
*
Glycerin ( Sani-Supp supository ® )
*
Magnesium hydroxide ( Phillips Milk of Magnesia ® )
*
Mineral oil
*
Psyllium hydrophilic mucilloid1 ( Metamucil ® )
*
Sodium phosphate ( Fleet Enema ® )
اختلالات جنسي :
*
Alprostadil ( Prostin VR ® )
*
Alprostadil ( MUSE ® )
*
Papaverine
*
Sildenafil ( Viagra ® )
درد :
*
Amitriptyline ( Elavil ® )
*
Carbamazepine ( Tegretol ® )
*
Clonazepam ( Klonopin® or Rivotril ® )
*
Gabapentin ( Neurontin ® )
*
Imipramine ( Tofranil ® )
*
Nortriptyline ( Pamelor® or Aventyl ® )
*
Phenytoin ( Dilantin ® )
اختلالات روحي ، رواني و شناختي :
*
Bupropion ( Wellbutrin ® )
*
Fluoxetine ( Prozac ® )
*
Paroxetine ( Paxil ® )
*
Sertraline ( Zoloft ® )
*
Venlafaxine ( Effexor ® )
سرگيجه :
*
Meclizine ( Antivert ® or Bonamine ® )
حساسيت به گرما و خارش متناوب :
*
Hydroxyzine ( Atarax ® )
تهوع و استفراغ :
*
Meclizine ( Antivert ® or Bonamine ® )
توجه این مطلب فقط برای افزایش اطلاعات درباره ی این بیماری است
برچسبها:
سكسكه چيست؟!
توضيح كلي
سكسكه عبارت است از انقباضات ناخودآگاه و مكرر عضله ديافراگم. سكسكه يك علامت است و نه يك بيماري. در ايجاد سكسكه ديافراگم (عضله بزرگ و نازكي كه قفسه سينه را از شكم جدا ميسازد) و عصب فرنيك (عصبي كه ديافراگم را به مغز وصل ميكند) نقش دارند. تقريباً همه ممكن است دچار سكسكه شوند، حتي جنيني كه در رحم مادر است.
علايم شايع
يك صداي تند و سريع كه در اثر گرفتگي ديافراگم از دهان خارج ميشود. اين گرفتگي، عضلات ته گلو را به هنگام دم ميبندد.
علل
تحريك اعصابي كه عضلات تنفسي، خصوصاً ديافراگم، را تحريك ميكنند. علت سكسكه كوتاهمدت معمولاً ناشناخته است. در صورتي كه سكسكه طولانيمدت باشد يا بهطور مكرر رخ دهد، امكان دارد به علل زير ايجاد شده باشد:
خوردن يا آشاميدن غذا يا نوشيدني داغ يا مواد تحريككننده
بيماريهاي پرده جنب (پرده نازكي كه روي ريهها را ميپوشاند).
ذاتالريه
اورمي (جمع شدن مواد زايد سمي در اثر نارسايي كليه)
الكلي بودن
مصرف بعضي از داروها
اختلالات معده، مري، روده يا لوزالعمده
حاملگي
تحريك مثانه
هپاتيت
گسترش سرطان از يك قسمت از بدن به كبد يا قسمتي از پرده جنب
سابقه عمل جراحي اخير، خصوصاً جراحي روي شكم
علل عاطفي
عوامل افزايش دهنده خطر
وجود يك بيماري كه سطح سلامت فرد را پايين آورده باشد.
سابقه عمل جراحي اخير
مصرف داروها، خصوصاً آنهايي كه معده را آزرده ميسازند.
پربودن معده
خنده شديد يا احساسات قوي
تغيير در دماي محيط
مصرف الكل
پيشگيري
در حال حاضر نميتوان از آن پيشگيري كرد.
عواقب مورد انتظار
سكسكه كوتاهمدت معمولاً نشاندهنده بيماري نيست. اين نوع سكسكه بهطور خود به خودي يا غالباً با درماني كه شرح آن داده خواهد شد برطرف ميشود. سكسكه مداوم فرد را مستأصل ميكند و نياز به انجام اقداماتي براي فهميدن دليل آن وجود دارد.
عوارض احتمالي
عارضهاي وجود ندارد، مگر اين كه سكسكه طولانيمدت باشد و وجود يك بيماري جدي را مطرح كند.
درمان
اصول كلي
روشهايي كه در اين جا ذكر ميشوند براي دورههاي كوتاهمدت سكسكه هستند. سكسكه طولانيمدت بايد تحت بررسي پزشكي قرار گيرد. يك يا تعداد بيشتري از روشهاي زير را به كار بنديد تا بهترين آنها براي شما معلوم شود.
نفس خود را نگاه داريد و تا 10 بشماريد.
داخل يك كيسه كاغذي تنفس كنيد. از كيسه پلاستيكي استفاده نكنيد زيرا ممكن است به سوراخ بيني بچسبد.
انگشت شست خود را بين دندانها و لب بالا قرار دهيد. سپس لب بالا را با انگشت سبابه خود، درست در زير سوراخ بيني سمت راست، فشار دهيد.
انگشتان سبابه خود را حدود 20 ثانيه داخل هر دو گوش فشاردهيد.
يك ليوان آب را به سرعت بنوشيد.
نان خشك يا يخ خرد شده قورت دهيد.
زبان خود را به ملايمت بكشيد.
چشمان خود را ببنديد و فشار ملايمي را به كرههاي چشم وارد كنيد.
يك قاشق چايخوري شكر خشك بخوريد.
داروها
معمولاً دارويي براي اختلال مورد نياز نيست.
فعاليت
محدوديتي براي آن وجود ندارد.
رژيم غذايي
رژيم خاصي توصيه نميشود.
در اين شرايط به پزشك خود مراجعه نماييد
اگر سكسكه بيش از 8 ساعت طول بكشد.
اگر احتمال ميدهيد كه دارويي باعث سكسكه شما شده است.
برچسبها:
الکترولیز

واکنش های شیمیایی درزندگی روزانه ما بسیار ضروری می باشند. خیلی ازفرآیندهای صنعتی مانند تولید مواد مختلف با واکنش های اکسایش- کاهشی در ارتباط هستند. این دسته از واکنش ها که نقش بسیار مهمی درمحدوده واکنش های شیمیایی در یک مسیر معین ایفا می کنند، همواره با نقل و انتقال الکترون در ارتباط می باشند. واکنشی که در آن الکترون دریافت می شود و ماده مورد نظر( عامل اکسنده ) کاهیده می شود واکنش کاهشی نام دارد.
همین طور واکنشی که درآن الکترون از دست داده می شود تا واکنش دهنده ( عامل کاهنده ) اکسید گردد و محصول مورد نظر تولید شود واکنش اکسایشی نام دارد.
در تصویر زیرمیخ آهنی طی واکنش اکسایش به یون های آهن اا و محلول سولفات مس ( یون های مس اا ) طی واکنش کاهشی به مسی که روی میخ آهنی قرار گرفته ، تبدیل شده است.
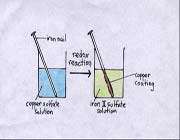
فرایند تبدیل انرژی شیمیایی به انرژی الکتریکی در یک سلول گالوانی ( ولتایی ) انجام می شود و به طور برعکس پدیده تغییرات شیمیایی با تبدیل انرژی الکتریکی به شیمیایی با عبور جریان الکتریسیته از میان یک الکترولیت، الکترولیز نامیده می شود.
ابتدا هامفری دیوی در سال 1807 با عبور جریان الکتریسیته از میان هیدروکسید پتاسیم مذاب با استفاده از الکترود پتاسیم، آزمایشات الکترولیزی را پایه ریزی کرد. یک محلول الکترولیتی یا یک الکترولیت مذاب شامل یون های منفی یا مثبت می باشد که به طور آزادانه در سرتاسر محلول حرکت می کنند. دراین جا پتانسیل الکتریکی در محلول زمانی برقرار می شود که یون ها به طرف الکترود مورد نظر به درستی حرکت کنند.
کاتیون ها( یون های دارای بار مثبت ) به طرف قطب منفی که کاتد نامیده می شود متمایل می گردند و آنیون ها ( یون های دارای بار منفی ) نیز به طرف قطب مثبت که آند نامیده می شود، حرکت می کنند. در نزدیکی سطح الکترود ، یون ها در یک سری واکنش های شیمیایی شرکت می کنند. کاتیون ها درالکترود کاتد کاهیده و آنیون ها در الکترود آند اکسید می شوند. بنابراین محلول الکترولیت با عبور جریان الکتریسیته به یون های تشکیل دهنده اش تجزیه می گردد. محصولات این دسته از واکنش های الکترودی :
- ممکن است در سطح الکترود گذاشته شوند و در همان جا بمانند.
- ممکن است به شکل محصولات گازی ظاهر شوند.
- ممکن است در محلول به صورت یونی حل شوند.
ماده ای که به طور مستقیم در سطح تشکیل می شود محصول اولیه نامیده می شود و این فرایند به عنوان تغییر اولیه نام گذاری شده است . محصولات اولیه ممکن است تغییرات بیشتری را برای تشکیل مولکول ها یا ترکیبات جدیدتر متحمل گردند.
برای مثال الکترولیز آب می تواند آن را به هیدروژن و اکسیژن تجزیه کند.
فرآیند الکترولیز:
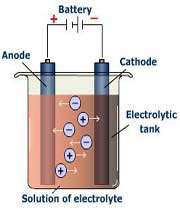
الکترولیز در یک دستگاه طراحی شده مخصوصی به نام سلول الکترولیتی انجام می شود. یک سلول الکترولیتی که ظرفی از جنس شیشه یا هر ماده پلاستیکی مناسب می باشد،مخزن الکترولیتی نامیده می شود و به لحاظ رسانش الکتریکی ضعیف است. دو الکترود که در سلول الکترولیتی قرار دارند با محلول الکترولیت یا الکترولیت مذاب در ارتباط می باشند. درنهایت با اتصال الکترودها به باتری ( منبع جریان مستقیم )، جریان الکتریسیته ازدرون محلول عبورداده می شود.
برچسبها:
سوختن هیدروکربن ها
هیدرو کربن ها ساده ترین ترکیبات آلی هستند .
کوچک ترین و ساده ترین عضو خانواده هیدرو کربن ها متان می باشد که تنها از یک اتم کربن و چهار اتم هیدروژن تشکیل شده است.
تمام ترکیبات آلی می توانند از هیدروکربن ها به وسیله جانشین شدن یک اتم هیدروژن با یک گروه عاملی مناسب تشکیل شوند.
جانشینی یک اتم هیدروژن توسط یک گروه OH در یک هیدروکربن، الکل را تشکیل می دهد. جایگزینی اتم هیدروژن در یک هیدروکربن توسط گروه COOH ،اسید کربوکسیلیک را پدید می آورد وغیره.
طبقه بندی هیدروکربن ها:
بااین که میلیون ها ترکیب آلی وجود دارد اما تقریبا غیر ممکن است که تک تک ترکیبات را به لحاظ فیزیکی مطالعه کنیم.
ترکیبات آلی را جهت مطالعه آسان تر، به گروه ها و زیر گروه های مختلف دسته بندی می کنند.این ترکیبات را می توان به دو دسته کلی تقسیم بندی کرد:
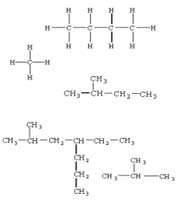
سوختن هیدروکربن ها:
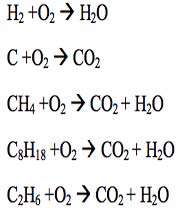
متان، بنزن، شمع ( پارافین ) جزو هیدروکربن ها محسوب می شوند و زمانی که در اکسیژن سوزانده می شوند بخار آب و دی اکسید کربن را تولید می نمایند. شمعی را در درون یک استوانه حاوی اکسیژن قرار می دهیم. ابتدا شمع با روشنایی خوبی مطابق شکل زیر می سوزد.
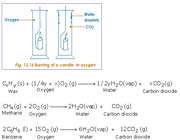
به دنبال آن جداره داخلی ظرف حاوی گاز اکسیژن مه آلود می شود که این مسئله از به جا ماندن قطرات ریزآب روی جداره ناشی می شود. برای این که از تشکیل گاز دی اکسید کربن در استوانه مطمئن شویم، مقداری آب آهک به داخل استوانه روانه می کنیم. بعد از مدتی خواهیم دید آب آهک با گاز دی کسید کربن ترکیب شده و محلولی شیری رنگ را تولید کرده است. این محلول حضور گاز دی اکسید کربن را تایید می کند.
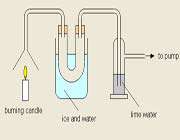
برچسبها:
چرا اکسیژن مایع جذب آهن ربا می شود؟


این عکس یک آهن ربای قوی را نشان می دهد.

در این مرحله می خواهیم نیتروژن مایع را برروی قطب های آهن ربا بریزیم و رفتار نیتروژن مایع را مشاهده کنیم.معمولا نیتروژن مایع را در فلاسک های شیشه ای عایق دار به نام محفظه عایق حرارتی با دو جداره قرار می دهند.
نیتروژن مایع نمی تواند به قطب های آهن ربا بچسبد. برای مشاهده این فیلم این جا کلیک کنید.

دراین شکل لوله شیشه ای حاوی اکسیژن مایع را مشاهده می کنید.گاز اکسیژن مایع شده با توجه به عکس، آبی رنگ می باشد.
اکسیژن مایع قابلیت چسبیدن به آهن ربا را دارد. برای مشاهده این فیلم این جا کلیک کنید.
در واقع اکسیژن مایع بین قطب های آهن ربا می ماند تا زمانی که در شرایط دمایی بالا (جوگرم) تبخیر شود. بنابراین دیدیم که اکسیژن مایع توانایی چسبیدن به قطب های آهن ربا را دارد در حالی که نیتروژن مایع این چنین قابلیتی را ندارد و در واقع این امر مربوط به تفاوت در ساختار الکترونی شان می باشد.
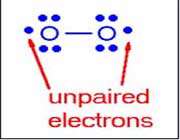
در ساختار لوییس امکان پذیر برای اکسیژن، یک الکترون ناپیوندی روی هر اتم اکسیژن قرار دارد. بنابراین مولکول های دارای الکترون های نا پیوندی (غیر جفت شده) را،پارامغناطیس می نامند که دارای خواص مغناطیسی می باشند.

در ساختار لوییس نیتروژن، الکترون های ناپیوندی وجود ندارد.در نتیجه مولکول هایی که الکترون ناپیوندی ندارند و همه الکترون هایشان جفت می باشد را، دیا مغناطیس می نامند که به دنبال این مطلب از خواص مغناطیسی برخوردار نمی باشند.
برچسبها:
قانون شارل - گیلوساک
شارل این قانون را درسال 1787 با دادن رابطه ای بین حجم و فشار یک گاز فرمول بندی کرد.
این قانون بیان می کند که در فشار ثابت، حجم جرم معینی از گاز توسط 273/1 حجمش در دمای صفر درجه سانتی گراد برای هر یک درجه افت و خیز ، کاهش و یا افزایش می یابد. برای هر یک درجه افزایش در دما می باشد :
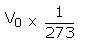
بنابراین، حجم کل در دمای t به صورت زیر در نظر گرفته می شود :
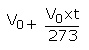
و یا به شکل ساده تر :
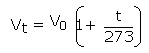
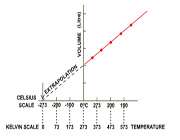
نموداری را می توان رسم کرد که در آن حجم در طول محور y و دما در طول محور x باشد و این نمودار، خطی راست را با عرض از مبدأ در نقطه ای روی محور y نشان می دهد:
زما نی که این خط را به سمت دماهای پایین تر برون یابی کنیم، این خط محور x را در جایی قطع خواهد کرد که به آن ، حجم در دمای صفر درجه سانتی گراد می گویند.
شکل 1- نمودار حجم در مقابل دما (تحت شرایط فشار ثابت)
دمایی که در آن حجم گاز صفر می شود دمای 273- درجه سانتی گراد است که مستقل از ماهیت و فشار گاز می باشد. پایین ترین دمایی که زیرآن حجمی وجود ندارد( منفی)، دمای صفر مطلق نامیده می شود و نیز اندازه گیری های دما بر اساس دمای صفر مطلق به عنوان مقیاس دمای مطلق یا مقیاس دمای کلوین شناخته می شود.
در نتیجه قانون شارل را با توجه به مطالب مزبور می توان به شکل زیر فرموله کرد:
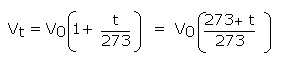
که در این جا 273+T = t نشان دهنده دما بر حسب کلوین و 273 = T0 می باشد.
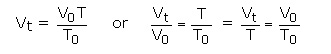
بنابراین V / T ثابت می باشد.
رابطه بالا ممکن است به شکل زیر نوشته شود:
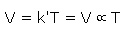
در نتیجه حجم جرم معینی از گاز به طور مستقیم با دمای مطلق گاز در فشار ثابت متناسب است. اگر V1 حجم جرم مشخصی از گاز در دمای T1 و V2 حجم همان جرم از همان گاز در دمای T2 در فشار ثابت باشد، بنابراین می توان نوشت :
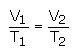
صحت قانون شارل را می توان با اندازه گیری حجم هایی از یک جرم معین ازگازی در دماهای مختلف در شرایط فشار ثابت تعیین کرد. در این بررسی ها در تمام مراحل مقدار V / T به صورت ثابت باقی می ماند.
نمودار به دست آمده از نسبت حجم - دما در مقابل فشارهای مختلف، منحنی های هم فشار نامیده می شود. شارل همچنین ماهیت توسعه یافته ی گازهایی را با چگالی پایین توصیف کرد.
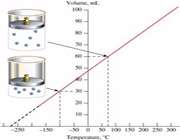
مسئله :
یک نمونه از گاز هلیوم دارای حجم 520cm3 در دمای 100 درجه سانتی گراد می باشد. دمایی که در آن حجم گاز به 260cm3 می رسد را محاسبه کنید؟ فرض کنین که فشار ثابت است.
راه حل:
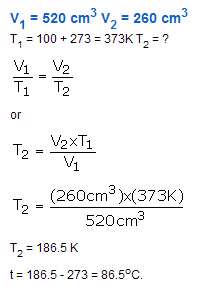
برچسبها:
قانون بویل
رابرت بویل این قانون را در سال 1662، با دادن رابطه ای بین فشار و حجم جرمی معین از یک گاز در دمای ثابت، پیشنهاد کرد.
این قانون بیان می کند که در دمای ثابت حجم جرمی معین از گاز با فشار آن گاز به طور عکس متناسب است که به صورت زیر بر قرار است :
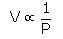
در شرایطی که دما ثابت است و یا PV = K = ثابت. زمانی که در یک دمای معین فشار گاز از P1 به P2 تغییر کند، رابطه می نتیجه شود:
P1V1 = P2 V2 = ثابت
در جایی که V2 حجم نهایی گاز محسوب می شود. حاصل ضرب حجم و فشار یک جرم معین از گاز در دمای ثابت، یک مقدار ثابتی می شود. از نظر آزمایشگاهی می توان این مسئله را با تهیه کردن نمودار فشار - حجم برای 10g از گاز اکسیژن در دمای 25 درجه سانتی گراد تأیید کرد. در نهایت مشاهده خواهد شد که با افزایش فشار، حجم کاهش می یابد و حاصل ضرب PV به صورت ثابت برقرار می گردد.
شکل 1 - تغییر فشار و حجم در دمای ثابت
منحنی نشان می دهد که ارتباط بین فشار و حجم به طور عکس می باشد. زمانی که فشار، P1 است، حجم V1 و زمانی که فشار به P2 افزایش می یابد، حجم V2 کمتر از حجم V1 می شود. اگر بخواهیم نمودار را به صورت فشار بر حسب عکس حجم رسم کنیم به شکل خطی راست که از مبدأ عبور می کند، به دست می آید:
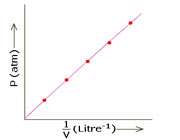
شکل 2 - نمودار فشار در مقابل عکس حجم
و در حالی که نمودار را به صورت حاصل ضرب PV (در طول محور y ) بر حسب فشار (در طول محور x ) رسم کنیم، به شکل خطی افقی به دست می آید که PV نشان دهنده ی یک مقدار ثابت می باشد حتی در شرایطی که ما فشار را تغییر دهیم.
منحنی فشار - حجم در دماهای مختلف برای یک گاز معین، متفاوت است. نمودار PV در مقابل P در دمای متفاوت به عنوان نمودار هم دما شناخته می شود به طوریکه منحنی بالاتر مربوط به دمای بالاتری می شود. قانون بویل در واقع طبیعت تراکم پذیر گاز را که اندازه ای از دانسیته ی افزایش یافته اش می باشد، بیان می کند.
مسئله :
گازی با حجم 250ml در فشار 745 میلی متر جیوه و در دمای 25 درجه سانتی گراد می باشد. برای این که حجم گاز به200ml کاهش یابد، به چه افزایش فشاری در همان غلظت نیاز است ؟
راه حل :

بنابراین افزایش فشار، به صورت زیر می شود:
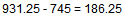
در نتیجه افزایش فشار 25/186 میلی متر جیوه می شود.
برچسبها:
نیتروژن مایع
نیتروژن مایع، حالت مایع عنصر نیتروژن می باشد که از تقطیر جزء به جزء هوای مایع به دست می آید. تقطیر جزء به جزء ، یکی از انواع تقطیر برای جداسازی اجزای یک مخلوط می باشد که در این جا اجزاء از طریق حرارت و گرما، به ترتیب به نقاط جوش شان می رسند. نیتروژن مایع به صورت های LIN ، LN2 و LN نشان داده می شود.
اطلاعات بیشتر در مورد نیتروژن مایع:
- نیتروژن مایع بی رنگ، بی بو و بی مزه است و بیشتر شبیه آبی است که در حال جوش آمدن است.
- نیتروژن مایع یک سیال سرمازا می باشد که در تماس با بافت زنده موجب یخ زدگی و سرمازدگی آن بافت می شود.
- در فشار جو، نیتروژن مایع در 77 کلوین که برابر با 196- درجه سانتی گراد و 321- درجه فارنهایت است، به جوش می آید.
- نیتروژن، بی اثر است و به فرآیند احتراق هیچ گونه کمکی نمی کند.
- اگر اکسیژن موجود در هوا از طریق تبدیل نیتروژن مایع به گاز تولید شود، منجر به خفگی می شود.
کاربرد های نیتروژن مایع:
- نیتروژن مایع برای فرآیند های برودتی و سرمازایی مورد استفاده قرار می گیرد.
- به عنوان خنک کننده برای سخت افزار کامپیوتر.
- به عنوان خنک کننده برای دوربین های CCD در علم نجوم.
- جهت ذخیره، نگهداری و انتقال فرآورده های غذایی.
- نیتروژن مایع به عنوان منبع گاز نیتروزن خیلی خشک، عمل می کند.
اطلاعات مفید:
- در شرایطی که نیتروژن مایع با نسبت 1 به 694 به گاز تبدیل شود، مقادیر زیادی نیرو تولید می کند.
- دمای بیش از اندازه پایین نیتروژن مایع منجر به یخ زدگی شدید می شود.
اثر نیتروژن مایع بر روی بادکنک

زمانی که یک بادکنک به وسیله نیتروژن مایع سرد می شود، چه اتفاقی می افتد؟
بر طبق معادله حالت گازها ( nRT = PV )، حاصل ضرب فشار - حجم برای گاز ایده آل با دمای مطلق متناسب است.
بنابراین بر طبق رابطه ی مزبور، زمانی که دما پایین می آید، حاصل ضرب فشار - حجم نیز کاهش می یابد و در نتیجه بادکنک متلاشی می شود ( در واقع طبق قانون شارل، دما با حجم رابطه ی مستقیم دارد).
بیشتر بدانید:
معادله حالت گازها ( nRT = PV )، ابتدا توسط امیل کلایپرون در سال 1834 با ترکیب قوانین بویل و شارل به دست آمد.
البته می توان این معادله را از تئوری سینتیکی ( بخشی از زمینه های تخصصی علم شیمی ) به دست آورد که ابتدا توسط آگوست کرونی در سال 1856 و به دنبال آن ، رودلف کلازیوس در سال 1857 ارائه گردید.
در این معادله، P فشار مطلق گاز، V حجم، n مقدار مولی ماده، R ثابت گازی و T دمای مطلق ( بر حسب کلوین ) می باشد. در واقع معادله ی حالت گاز ایده آل با صرف نظر کردن از اندازه ی مولکولی گازها و جاذبه ی بین مولکولی آن ها، در دمای بالا و فشار پایین صادق است.
اثر نیتروژن مایع بر روی گل رُز

زمانی که یک گل رٌز در نیتروژن مایع فرو می رود، چه اتفاقی می افتد؟
ظرف شیشه ای عایق دار شامل گاز نیتروژن مایع شده است که در دمای اتاق، 196 - درجه سانتی گراد می باشد. در مرحله بعد، نیتروژن می جوشد، چون گرما را از اتاق جذب می کند. در این جا دمای اتاق در حدود 225 درجه گرم تر از مایع است.
در فیلم زیر مشاهده خواهید کرد که گل رٌز به سرعت در نیتروژن مایع یخ می زند.
بنابراین گل رٌز مانند یک ظرف چینی آن قدر سخت و شکننده می گردد که به آسانی شکسته می شود.
برچسبها:
فشار بخار مایعات

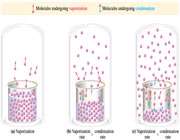
فشار بخار به صورت فشار جزئی اعمال شده توسط بخار بالای سطح مایع تعریف می شود که این بخار در یک دمای معینی با مایع به تعادل می رسد.
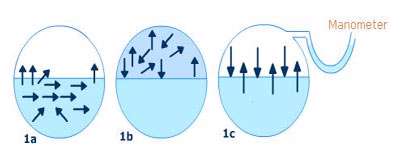
در تصویر 1a و 1b، حالات مایع و بخار یک ماده ی معین نشان داده شده است. در این اشکال مولکول های منفرد یا اجزاء در یک لحظه ی خاص با حرکت تصادفی شان نشان داده شده اند. زمانی که لحظه ی تعادل نزدیک می شود( تصویر 1c )، تعداد مولکول های بخار شده با تعداد مولکول های متراکم شده برابر می شود. در واقع سرعت تبخیر با سرعت تراکم برابر می گردد و فشار خوانده شده روی مانومتر M ، فشار بخار آن مایع در آن دماست.
در کل فشار بخار یک مایع به دو فاکتور زیر بستگی دارد:
- ماهیت و طبیعت مایع.
- دمای مایع.
ماهیت مایع :
مایعاتی که دارای نیروهای بین مولکولی ضعیفی هستند، فرارترند و فشار بخار بالاتری دارند. برای مثال، فشار بخار اتیل الکل بیشتر از فشار بخار آب است.
دمای مایع :
فشار بخار با افزایش دما، افزایش می یابد. این مسئله بدین علت است که با افزایش دما، سرعت تبخیر نیز، افزایش می یابد.
برچسبها:
آب اکسیژنه

آب اکسیژنه یا هیدروژن پراکسید دارای خواص شیمیایی جالبی می باشد به دلیل آن که همان اندازه که عامل احیا کننده ی خوبیست، عامل اکسید کننده ی خوبی( اکسیدان) نیز می باشد. البته این شرایط هم در محلول های اسیدی و هم در محلول های قلیایی برقرار است.
عدد اکسایش اکسیژن در هیدروژن پراکسید، 1- می باشد، بنابراین آب اکسیژنه می تواند به O2 که دارای عدد اکسایشی صفر است اکسید شود و یا به H2O و یا -OH که هر دو عدد اکسایشی شان 2- می باشد، نیز کاهش یابد. در کل، هیدروژن پراکسید یک عامل اکسید کننده ی قوی می باشد.
پایداری:
از نظر حرارتی، هیدروژن پراکسید با توجه به معادله ی زیر ناپایدار می باشد:
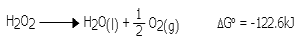
واکنش از چپ به راست یک فرآیند خود به خودیست که با کاهش انرژی همراه است. اما تجزیه ی هیدروژن پراکسید در دمای 250C و در غیاب کاتالیزور، کند صورت می گیرد. پلاتین، نقره، مس، کبالت، دی اکسید منگنز، آهن و غیره از جمله کاتالیزورهایی هستند که تجزیه ی آب اکسیژنه را سرعت می بخشند.
البته برای این واکنش تثبیت کننده هایی مثل اسیدها، استانیلید، استانات ها و پیرو فسفات ها نیز وجود دارد.
هیدروژن پراکسید در غلظت های بیشتر از 65 درصد، مخلوط های انفجاری قوی ای را با خیلی از ترکیبات آلی تشکیل می دهد.
تا حتی در تماس با آن دسته از ترکیبات آلی نیز، عمل افروزش و یا احتراق صورت می گیرد.
اطلاعات بیشتر:
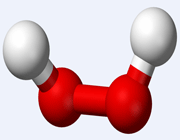
هیدروژن و اکسیژن به غیر از آب، اکسید دیگری را به نام هیدروژن پراکسید تشکیل می دهند که دارای فرمول مولکولی H2O2 می باشد. آب اکسیژنه در سال 1918 توسط تنارد ( Thenard ) کشف شد.

تنارد هیدروژن پراکسید را به صورت مقادیر ناچیز از واکنش نور خورشید بر روی آب دارای اکسیژن حل شده، بدست آورد. خواص شیمیایی H2O2 به طور گسترده متفاوت از خواص شیمیایی آب می باشد.
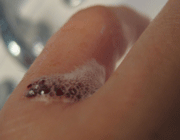
در استفاده از آب اکسیژنه بایستی به خوبی دقت کنیم. تصاویر زیر اثر آب اکسیژنه ی غلیظ بر روی پوست را نشان می دهد.
خواص فیزیکی:

- انیدرید هیدروژن پراکسید یا هیدروژن پراکسید بی آب یک مایع شربتی بی رنگ است. در لایه های ضخیم تر دارای رنگ جزئی متمایل به آبی می باشد. هیدروژن پراکسید امتزاج پذیر و یا حل پذیر با آب در هر نسبتی می باشد.
- H2O2 به راحتی در اثر گرما قبل از رسیدن به نقطه ی جوش ( bp ) تجزیه می شود. اما در کل تعیین نقطه ی جوش نرمال و یا طبیعی آن در فشار اتمسفری غیر ممکن است. نقطه ی جوش نرمال تخمین زده شده برای آن، 1520C و نقطه ی ذوب نیز 0.4oC- می باشد. آب اکسیژنه کریستال های منشوری را در دمای 20C- تشکیل می دهد.
- آب اکسیژنه به عنوان یک اسید ضعیف در نظر گرفته می شود. اما با این حال، انیدرید H2O2 نمی تواند آبی لیتموس را قرمز کند.
کاربرد ها:
- H2O2 به عنوان ضد عفونی کننده و ضد باکتری بی ضرر و نیز برای تمیز کردن جراحات و زخم ها مورد استفاده قرار می گیرد.
- آب اکسیژنه به عنوان عامل سفید کننده برای لباس های ظریف و لطیف، پشمی، ابریشمی و خمیر چوب نیز استفاده می شود.
- محلول غلیظ H2O2 به عنوان یک اکسیدان برای سوخت موشک ها نیز مورد استفاده قرار می گیرد.
- به عنوان عامل اکسید کننده در آزمایشگاه نیز کاربرد دارد.
برچسبها:












 آمار
وب سایت:
آمار
وب سایت:

