مانومتر
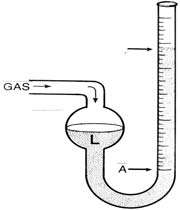
مانومتر وسیله ای برای اندازه گیری فشار است. نمونه ی معمولی مانومتر، شامل یک لوله ی U شکل از جنس شیشه است که با مقداری مایع پر شده است که معمولاً مایع مربوطه ،جیوه می باشد( به علت دانسیته ی بالا ). البته نمونه های دیجیتالی آن نیز در حال حاضر موجود می باشند.


مورد (1):
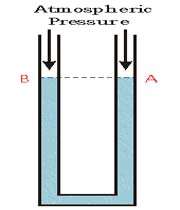
در این شکل هر دو پایانه ی لوله در مقابل جو باز هستند. بنابراین هر دو نقطه ی A و B در مقابل فشار جو قرار دارند و همچنین هر دو نقطه دارای ارتفاع عمودی هستند.
مورد (2):
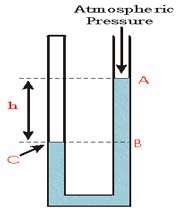
در این شکل بالای لوله در قسمت چپ بسته شده است. ما تصور می کنیم که در این جا یک نمونه گاز در پایانه ی بسته ی لوله قرار دارد. طرف راست لوله در مقابل جو، باز نگه داشته شده است. بنابراین نقطه ی A ، در فشار جو قرار دارد. نقطه ی C، فشار گاز در پایانه ی بسته ی لوله است. نقطه ی B دارای فشار بیشتری از فشار جو می باشد که این مسئله مربوط به وزن ستون مایع با ارتفاع h می باشد. نقاط C و B دارای ارتفاع یکسانی هستند، بنابراین دارای فشار یکسانی نیز می باشند و فشار نقطه ی C برابر با فشار گاز در پایانه ی بسته ی لوله می باشد.
بنابراین در این شکل، فشار گازی که در پایانه ی بسته ی لوله به دام افتاده است، بیشتر از فشار جو می باشد.
مورد (3):
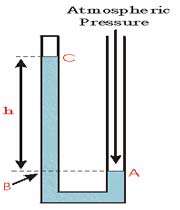
نمونه ی دیگری از مانومتر که در آن قسمت بالای طرف چپ بسته شده است. شاید این طرف لوله شامل یک گاز و یا شاید شامل محیط خلأ باشد. نقطه ی A در فشار جو قرار دارد. نقطه ی C دارای فشار گازی است که در پایانه ی بسته قرار دارد و یا شامل یک محیط خلأ با فشار صفر می باشد.
چون نقطه ی B دارای ارتفاع یکسانی با نقطه ی A است، بنابراین بایستی در فشار جو نیز قرار گرفته باشد. اما فشار در B مجموع فشار در C به اضافه ی فشار اعمال شده به وسیله ی وزن ستون مایع با ارتفاع h در لوله است.
بنابراین نتیجه می گیریم که فشار در C، کم تر از فشار جو می باشد. اگر پایانه ی بسته ی لوله شامل محیط خلأ باشد، فشار در نقطه ی C، صفر است و فشار جوی برابر با فشار اعمال شده از طریق ستون مایع با ارتفاع h است. در این شکل، مانومتر می تواند به عنوان یک بارومتر برای اندازه گیری فشار جو مورد استفاده قرار گیرد.
به دست آوردن رابطه ی فشار ستون مایع :
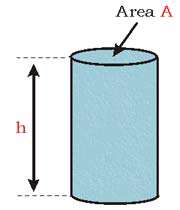
نیرویی که از طریق ستون مایع اعمال شود را به صورت زیر در نظر می گیریم :
F = mg
همان طور که می دانید فشار به صورت نیروی اعمال شده بر سطح تعریف می گردد که در SI دارای واحد پاسکال می باشد:
P = F / A
جرم استوانه به صورت حاصل ضرب چگالی در حجم به دست می آید:
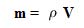
حجم استوانه نیز از حاصل ضرب سطح A در ارتفاع h به دست می آید:
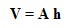
بنابراین فشار P می شود:
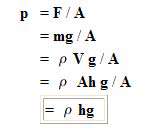
در نتیجه اگر چگالی، ارتفاع و شتاب گرانشی بر حسب واحد های SI به دست آیند، فشار بر حسب پاسکال به دست خواهد آمد. توجه کنید که مقدار فشار مستقل از سطح استوانه می باشد.
برچسبها:
واکنش های گرماده و گرماگیر
مقدمه:
دو نوع واکنش که بر اساس تغییرات گرما صورت می پذیرند به نام های واکنش های گرماده و گرماگیر می باشند.
واکنش های گرماده:

آن دسته از واکنش هایی که در آن ها گرما تولید می شود را واکنش های گرماده می گویند.
مثال:
1) زمانی که کربن در اکسیژن برای تشکیل کربن دی اکسید می سوزد، مقادیر زیادی گرما تولید می کند.
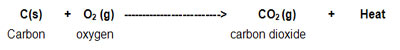
بنابراین سوختن کربن در اکسیژن به جهت تولید گرما، یک واکنش گرماده می باشد. در یک واکنش گرماده، گرمادهی واکنش به صورت نوشتن " Heat +" یا " Heat energy + " ( انرژی گرمایی ) و یا فقط " Energy + " در طرف محصولات معادله ی واکنش، مشخص می شود.
2) تنفس نیز مثالی از واکنش گرماده است. زیرا در طی این فرآیند، انرژی تولید می شود. در واقع در فرآیند تنفس، گلوکز با اکسیژن در سلول های بدن ما ترکیب می شود و در نهایت دی اکسید کربن و آب به همراه مقادیری انرژی گرمایی تولید می کند.
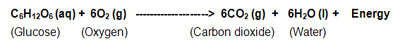
واکنش های گرماگیر:
آن دسته از واکنش هایی که برای انجام آن ها گرما جذب می شود، به عنوان واکنش های گرماگیر تعریف می شوند.
مثال:
1) زمانی که نیتروژن و اکسیژن در یک دمای خیلی بالایی (در حدود 3000oC ) برای تشکیل نیتروژن مونوکسید ترکیب می شوند، مقادیر زیادی گرما برای این واکنش جذب می کنند.

بنابراین واکنش بین نیتروژن و اکسیژن که منجر به تشکیل نیتروژن مونوکسید می شود، به دلیل جذب گرما جزء واکنش های گرماگیر محسوب می شود. یک واکنش گرماگیر معمولا با نوشتن " Heat +" یا " Heat energy +" و یا فقط
" Energy + " در طرف واکنش گرهای یک معادله ی واکنشی، مشخص می شود.
2) تمام واکنش های تجزیه ای برای انجام شدن نیاز به کسب انرژی ( به صورت نور، گرما یا الکتریسیته ) دارند. برای مثال، زمانی که به کلسیم کربنات گرما داده می شود، این ماده به کلسیم اکسید و کربن دی اکسید تجزیه می شود.

برچسبها:
رسانایی محلول ها
مقدمه:
ضروریست که قبل از پرداختن به مسئله ی هدایت الکتریسیته از میان محلول الکترولیتی، حداقل شرایط را توصیف کنیم. مقاومت الکتریکی به وسیله ی نماد R نشان داده می شود و اندازه ی آن بر حسب اُهم است که در واحد SI برابر با kgm2 / S3A2 می باشد. مقاومت الکتریکی ارتباط مستقیم با طول و ارتباط معکوس با سطح مقطع اجسام دارد.
رسانایی محلول های الکترولیتی:
واحد رسانایی در SI، زیمنس است که به وسیله ی نماد S نشان داده می شود و برابر با عکس آُهم ( ohm-1 ) می باشد. دقیقا نقطه ی مقابل مقاومت ویژه، رسانایی یا رسانندگی نامیده می شود. هدایت الکتریسیته از میان فلزات، رسانایی الکتریکی یا رسانایی فلزی نامیده می شود که این مسئله به علت حرکت الکترون ها ایجاد می شود.
هدایت الکتریسیته به عوامل زیر بستگی دارد:
- ماهیت و ساختار فلز
- مقدار الکترون والانس (ظرفیتی) در اتم
اندازه گیری رسانایی محلول یونی:
اندازه گیری مقاومت یک محلول یونی با دو مشکل مواجه است:
- عبور جریان مستقیم، ترکیب محلول را تغییر می دهد.
- محلول ها نمی توانند به سیم فلزی متصل شوند.
اولین مسئله را با استفاده از یک منبع قوی جریان متناوب حل می کنیم. مسئله ی دوم نیز با بکارگیری ظرف طراحی شده ی ویژه ای به نام سلول رسانندگی ( رسانایی ) رفع می شود.
تفاوت رسانایی و رسانایی (هدایت) مولی با غلظت:
رسانایی الکترولیتی و رسانایی مولی هر دو با جذب الکترولیت تبدیل و تغییر شکل می یابند. در هر دو، برای الکترولیت های قوی و ضعیف با کاهش غلظت، رسانایی نیز کاهش می یابد.
این مسئله را می توان این گونه توجیه کرد که در واقع با کاهش غلظت به سمت محلول رقیق حرکت می کنیم و در این جا چون تعداد یون های در واحد حجم که در محلول حامل جریان الکتریسیته هستند، کاهش می یابد(با رقیق کردن محلول) بنابراین رسانایی نیز کاهش یافته است.
رسانایی الکترولیتی از یک واحد حجم محلول در بین دو الکترود پلاتینی با سطح مقطع A تعیین می شود. رسانایی مولی محلول در غلظت معین، در واقع رسانایی حجم محلول (V) شامل یک مول از الکترولیت است که در بین دو الکترود با سطح مقطع A واقع شده که با فاصله ی L از یکدیگر قرار دارند.
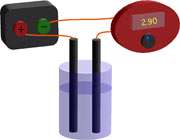
تصاویر زیر مربوط به اتصالات دستگاه رسانندگی سنج الکترولیت می باشد که در آزمایشگاه تهیه شده است.
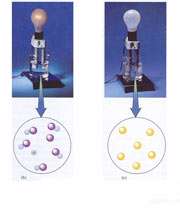
تصویر زیر مربوط به محلول های الکترولیت ضعیف و غیر الکترولیت است.
تصویر b در سمت چپ، محلول استیک اسید است که یک الکترولیت ضعیف را نشان می دهد و چون محلول آن دارای تعداد یون های کمی است، بنابراین همانند الکترولیت قوی جریان را به خوبی هدایت نمی کند. پس لامپ روشنایی کمی را تولید می کند.
اما تصویر c در سمت راست، محلول ساکارز که غیر الکترولیت است را نشان می دهد. چون در این جا اصلا در محلول، یونی وجود ندارد و ماده به شکل مولکولی در محلول می باشد، بنابراین هیچ جریانی از محلول عبور نمی کند و در نتیجه لامپ خاموش باقی می ماند.
برچسبها:
نفوذ مولکولی
نفوذ مولکولی در شیمی فرآیندی است که در آن مولکول ها از میان یک حفره بدون این که با یکدیگر برخوردی داشته باشند، به طور مستقیم و انفرادی عبور می کنند.
بر طبق قانون نفوذ مولکولی گراهام، سرعت نفوذ گازها (تعداد مولکول های عبور کرده از حفره در ثانیه) به وزن مولکولی گاز ها بستگی دارد. در واقع گازهایی که وزن مولکولی کم تری دارند سریع تر از گازهایی که وزن بیشتری دارند، از درون حفره عبور می کنند.
جذر میانگین مجذور سرعت مولکولی ( Vrms ) هر گازی می تواند با بکار گیری معادله ی زیر بدست آید:
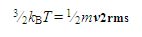
در جایی که KB ، ثابت بولتزمن می باشد. بنابراین مولکول های سبک تر ، سرعت بالاتری دارند.
قانون گراهام که به عنوان قانون نفوذ مولکولی گراهام ثبت گردیده، توسط شیمی فیزیکدان اسکاتلندی به نام توماس گراهام ( Thomas Graham ) فرمول بندی شده است.
گراهام به طور تجربی دریافت که سرعت نفوذ گاز با جذر وزن مولکولی گاز، به طور معکوس متناسب است.
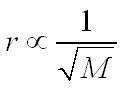
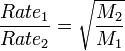
در جایی که Rate1، سرعت نفوذ اولین گاز، Rate2 سرعت نفوذ برای دومین گاز، M1 وزن مولکولی گاز اول و M2 وزن مولکولی گاز دوم است. تئوری کامل تری از قانون گراهام سال ها بعد به صورت تئوری سینتیکی و جنبشی گازها ارائه شد.
قانون گراهام در واقع اساس و پایه ای را برای تفکیک ایزوتوپ ها به وسیله ی نفوذ مولکولی، فراهم آورده است که این روش می تواند نقش بسیار سخت و بحرانی ای را در توسعه ی بمب اتمی ارائه دهد ( مبنایی برای تفکیک ایزوتوپ 235U از 238U ).
مثال:
اگر گاز اول، هیدروژن و گاز دوم، اکسیژن باشد بنابر رابطه ی قانون گراهام:
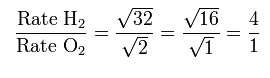
بنابراین مولکول های هیدروژن 4 برابر سریع تر از مولکول های اکسیژن نفوذ می کنند.
جهت یادگیری بیشتر آزمایش زیر را انجام دهید.
برچسبها:
لکه برها

پاک کردن لکه زرد زردچوبه بر روی بدنه بیرونی تفلون :
روی بدنه بیرونی ظرف تفلون لکه زردی بر اثر روغن حاوی زردچوبه تشکیل شده است. برای رفع آن چه می توان کرد ؟
پاسخ :
کمی سرکه به محل لکه دار ظرف بمالید و بعد از چند دقیقه آن را بشویید. البته توجه داشته باشید که هر لکه ایی اگر تازه ایجاد شده باشد بهتر پاک می شود. ولی در این مورد شما می توانید دو سه بار این کار را تکرار کنید و به نتیجه مطلوب برسید.
پاک کردن لکه زردچوبه از پارچه :
اگر لکه زردچوبه کهنه شده باشد به ندرت پاک می شود ولی در شرایط اولیه آن و البته به میزان کم، شما می توانید با مالیدن خمیر دندان بر روی آن و سپس شست و شو، آن را به طور کامل از بین ببرید.
البته پاشیدن اسپری مو نیز برای از بین بردن چنین لکه هایی ( پیش از شست وشو ) بسیار مفید است.
پاک کردن اثر انگشت روی دیوار :
در خانه بسیار اتفاق می افتد که جای انگشت بچه ها روی دیوار می ماند.
برای برطرف کردن اثر انگشت بچه و لکه های روی دیوار یک سیب زمینی را نصف کنید و با هر نصف سیب زمینی چندین بار در و پنجره و دیوار را بمالید و بعد با یک اسفنج جای لکه را پاک کنید( این دستور برای دیوارهای رنگ روغنی و پلاستیکی مفید است).
پاک کردن جوهر سیاه روی فرش :
برای از بین بردن جوهر سیاه روی فرش، مقداری ماست روی محل لکه ریخته و با قاشق ماست را جمع کنید. چند مرتبه این کار را تکرار کنید لکه کاملاً از بین می رود.
پاک کردن لکه جوهر روی لباس :
برای پاک کردن لکه جوهر خودکار یا خودنویس از شیر استفاده کنید. قسمت جوهری شده لباس را حدود پنج دقیقه داخل شیر قرار داده و سپس آن را با آب معمولی بشویید. اثر لکه جوهر کاملاً از بین خواهد رفت.
برای این منظور می توان از شیر ترش شده و یا دوغ نیز استفاده کرد. گاه برای برطرف شدن کامل اثر لکه، باید این کار چندین بار تکرار شود.
پاک کردن لکه واکس کفش :
اگر بر اثر بی احتیاطی مقداری واکس روی فرش یا لباستان مالید، می توانید ابتدا پنبه ای را خیس کنید و روی آن بکشید. سپس روی پنبه مقدای مایع ظرف شویی بریزید و بر روی لکه بکشید. بعد از این کار پنبه را آغشته به آب خالص کنید و دوباره روی لکه بکشید تا لکه کاملاً از بین برود.
اگر با این کار لکه از بین نرفت، مقداری الکل بر روی دستمال ریخته و روی لکه بکشید تا کاملاً تمیز شود.
اگر لباس قابل شستشو باشد، بعد از زدودن لکه، لباس را با پودر لباس شویی و آب نیم گرم کاملاً بشویید.
پاک کردن لکه سفیده تخم مرغ :
لکه سفیده تخم مرغ را هرگز با آب گرم نشویید، زیرا لکه ثابت می ماند. بلکه برای از بین بردن آن، محل لکه را با آب سرد کاملاً بشویید.
پاک کردن لکه روی کاشی ها :
برای پاک کردن لکه های معمولی روی کاشی ها، آن ها را با محلول زیر بشویید:
آمونیاک: نصف فنجان
سرکه سفید: نصف فنجان
جوش شیرین: یک چهارم فنجان
آب گرم: حدود چهار لیتر
در صورتی که کاشی ها خیلی کثیف شده اند مقداری جوش شیرین را با وایتکس مخلوط کرده و خمیری را که به دست می آید با استفاده از یک برس یا اسکاچ روی کاشی ها بمالید و پس از چند دقیقه آبکش کنید.
پاک کردن لکه قیر :
برای از بین بردن لکه قیر روی پارچه از بنزین و کره می توان استفاده کرد.
پاک کردن لکه گل و لای روی لباس :
کافی است یک عدد سیب زمینی را با چاقو به دو نیم کنید و بر روی لکه بمالید، سپس لباس را در آب سرد بخیسانید و طبق معمول با مواد شوینده شست و شو دهید. در صورتی که لکه همچنان پایدار ماند، دستمال را به الکل آغشته کنید و بر روی لکه بمالید.
نحوه کندن آدامس از مو :
بچه ها گاهی با آدامس خود بازی می کنند و آن را به جاهای مختلف مثل مو می چسبانند! اگر آدامس به موی کودک شما چسبید، می توانید برای کندن آن از دو روش زیر کمک بگیرید:
ـ روش اول: یک تکه یخ را چند بار روی آدامس بکشید تا سفت شود سپس آدامس را از مو جدا کنید.
ـ روش دوم: کمی کرم مرطوب کننده به همان قسمت مو بکشید، سپس با یک دستمال خشک، مو را چند بار پایین بکشید آدامس از آن جدا خواهد شد.
لکه خون را با چند روش می توان پاک کرد:
1-اگر لکه خون تازه است و خشک نشده محل لکه را با آب سرد و صابون بشویید تا بر طرف شود .
2- روی لکه خون را فوراً با خمیری که از مخلوط کردن آ ب سرد و نشاسته ذرت درست کرده اید بپوشانید و به آرامی کمی مالش دهید و آن را مقابل آفتاب بگذارید تا خشک شود. آفتاب خون را از پارچه خارج کرده و جذب نشاسته می کند. در صورت نیاز این عمل را چند بار تکرار کنید.
3- پارچه خونی را درون مخلوط آب سرد و نمک خیس کنید. آب را آن قدر عوض کنید تا لکه به طور کامل برطرف شود.
4- برای پاک کردن لکه های کوچک خون روی یقه پیراهن های مردانه (در اثر تراشیدن ریش)، کافی است چند قطره آب سرد روی هر لکه بریزید و سپس مقداری پودر نشاسته روی آن بپاشید. وقتی نشاسته خشک شد، پیراهن را بشویید لکه های خون برطرف خواهند شد.
نحوه پاک کردن خطوط کاربن از روی نایلون و رو میزی :
برای محو کردن این نوع لکه ها آب ژاول را با آب سرد مخلوط کرده روی لکه بمالید .
در صورتی که لکه روی پارچه ای که از الیاف مصنوعی تهیه شده ایجاد شد می توانید با آب لیموی خالص آن را بر طرف نمائید.
برای برطرف کردن لکه روی نایلون نیز می توانید از ابر همراه با پودر شستشو استفاده کنید.
لکه روغن ماشین :
تا به حال پیش آمده است که از کنار ماشین عبور کرده باشید و لباس شما سیاه شده باشد. برای این منظور روی لکه ها، کره یا روغن بمالید و بگذارید 12 ساعت بماند. سپس آن را با بنزین پاک کنید و این راه برای لباس های ابریشمی و کتانی است.
برای پارچه های چرمی می توانید مقداری وازلین روی روغن بمالید و بعد از یک ساعت و نیم با تتراکلرید کربن پاک کنید سپس با یک تکه پارچه پشمی آن را جلا دهید.
لکه های رنگ :
برای لکه زدایی رنگ ها باید بدانیم که چندین نوع رنگ داریم و بعداً برای هر نوع از آن ها تدبیر خاصی بیندیشیم.
سه نوع رنگ داریم:
1: لکه های مربوط به آبرنگ
2: لکه رنگ پلاستیکی
3: لکه رنگ روغنی.
1: زدودن لکه آبرنگ:
زدودن لکه آبرنگ ساده است برای این منظور باید با آب سرد بشویید سپس با آب نیم گرم و پودر رختشویی آن ها را تمیز بشویید و آب بکشید و اگر خیلی سمج باشد، پنبه را به گلیسیرین آغشته کنید و روی آن بمالید سپس با آب گرم و پودر رختشویی بشویید و آب بکشید و اگر نتیجه نگرفتید از تربانتین استفاده کنیم.
2: لکه های پلاستیکی:
ابتدا اضافی رنگ را بتراشید سپس نفت خام بمالید و با پنبه پاک کنید و سرانجام با آب گرم و صابون بشویید و آبکشی نمایید.
3: لکه های رنگی روغنی:
اگر کهنه و خشک است پاک کردن آن تقریباً غیر ممکن است اما در صورتی که هنوز خشک نشده و یا فقط یکی دو روز پیش اتفاق افتاده است باید چنین کرد:
از روی هر نوع پارچه، اضافه رنگ را با لبه ی تیز کارد بگیرید بعد پنبه ای را به تربانتین آغشته کنید و روی لکه بمالید سپس با پنبه دیگری پاک کنید این کار را چندین بار تکرار کنید و ته رنگ را نیز با آب گرم و پودر لباس شویی از بین ببرید مسلماً از نتیجه کار راضی خواهید بود.
لکه رنگ روی قالی :
لکه زدایی رنگ روی قالی و موکت مشکل تر است. برای پاک کردن آن ها باید پنبه را با تربانتین خیس کنید و روی لکه بمالید و بعداً با پنبه دیگری پاک کنید تا این که لکه از میان برود.
نحوه پاک کردن لکه سس گوجه فرنگی :
ابتدا روی سطح لکه را با روش ضربه ای به وسیله پارچه ای دیگر به الکل آغشته کنید، سپس در آب سرد و مواد شوینده بشویید.
اگر لکه روی سطح فرش یا موکت ایجاد شده باشد، ابتدا مقداری فوم ریش تراشی بر روی لکه بریزید و سطح آن را با اسفنج آن قدر مالش دهید تا پاک شود. سپس دستمال دیگری را کمی مرطوب کنید و بر روی لکه بکشید و صبر کنید تا خشک شود.
نحوه پاک کردن لکه رژ لب :
شما می توانید با مالیدن خمیر دندان بر روی این نوع لکه و سپس شست و شو، آن را به طور کامل از بین ببرید.
البته پاشیدن اسپری مو نیز برای از بین بردن چنین لکه هایی (پیش از شست وشو) بسیار مفید است. راه کار دیگر برای این منظور استفاده از الکل است.
نحوه پاک کردن لکه از روی پارچه مبل :
لکه نوشابه روی مبل :
برای از بین بردن لکه نوشابه می توانید کمی نمک بر روی لکه تازه بپاشید و بعد اسفنجی را خیس نموده روی لکه بکشید و سپس با آب گرم به وسیله اسفنج آبکشی کنید.
اثر سوختگی روی مبل :
برای از بین بردن اثر سوختگی یا زردی سیگار حبه قندی را روی لکه بکشید و آن قدر این کار را ادامه دهید تا لکه از بین برود. برای از بین بردن این نوع لکه اسفنجی را به شیر آغشته کنید و روی لکه بمالید .
در صورتی که لکه روی پارچه ای که از الیاف مصنوعی تهیه شده ایجاد شد می توانید با آب لیموی خالص آن را بر طرف نمایید.
چنانچه این لکه پارچه های کرک دار بود، ابتدا با کمی شیر، خوب لکه را خیس کنید و بعد با پنبه آن را پاک نمائید و در آخر با آب و صابون لکه های حاصل از شیر را بشویید.
لکه جوهر روی مبل :
اگر لکه مربوط به مرکب سیاه است ابتدا محل را خیس کرده روی آن کمی نمک آشپزخانه بریزید و سپس با پنبه مالش دهید و چنانچه نتیجه نگرفتید مخلوطی از گلیسرین و آمونیاک را روی لکه بمالید و سپس با آب و پودر دستی خوب شست و شو دهید. البته می توانیداز آب ژاول هم استفاده کنید.
لکه خون روی مبل :
بهترین چاره برای از بین بردن لکه خون هم این است که مقداری نشاسته را ( به نسبت بزرگی و کوچکی لکه ) در آب مخلوط کنید و به هم بزنید تا خمیر نسبتاً غلیظی بدست آید. آن گاه روی لکه خون را با این خمیر بپوشانید و بعد از خشک شدن نشاسته ها ، آن ها را بتراشید و با برس محل لکه را پاک کنید.
لکه میوه روی مبل :
اگر این لکه بر روی پارچه سفید بود ، کافی است با آب و صابون آن را بشویید. اگر لکه روی پارچه پشمی بود آب اکسیژنه 20% را با چند قطره آمونیاک مخلوط کرده، با آن لکه را پاک کنید. اگر لکه روی پارچه های ابریشمی سفید و یا رنگی بود آب و الکل سفید 90% را به نسبت مساوی مخلوط کرده و با آن لکه را محو کنید.
لکه چربی روی مبل :
برای از بین بردن لکه چربی قسمت لکه شده را با کمی محلول نمک و الکل بمالید. اگر لکه چربی روی پارچه ابریشمی است با یک برگ کاغذ خشک کن روی قسمت لکه شده را بپوشانید و اتوی داغ را محکم روی آن فشار دهید تا لکه ناپدید شود.
نحوه پاک کردن لکه شمع، مداد شمعی و مدادهای چرب آرایشی :
برای این منظور کافی است ابتدا باقی مانده ماده ایجاد کننده را با جسمی نوک تیز به آرامی بردارید. سپس دو تکه دستمال توالت یا کاغذ قهوه ای (مورد استفاده در خشک شویی ها) در دو طرف لکه قرار دهید. سپس اتوی گرم را بر روی یکی از کاغذها در محل لکه فشار دهید. به این ترتیب چربی موجود در لکه آب می شود و جذب دستمال یا کاغذهای طرفین می شود و لک از بین می رود.
ولی در مورد موکت و فرش پس از برداشتن پارافین سفت شده از روی سطح، تنها یک کاغذ بر روی سطح لکه قرار دهید و اتو بکشید.
نحوه پاک کردن چسب مایع از روی فرش یا موکت :
برای از بین بردن لکه چسب، پارچه ای را درون سرکه فرو برده روی لکه چسب بگذارید، به طوری که کاملا آن را اشباع کند، به زودی چسب سفتی خود را از دست داده و نرم خواهد شد که به راحتی جدا می شود.
لکه اتو :
نحوه رفع برق اتو روی لباس :
اگر پارچه و لباس شما بر اثر اتو کشیدن برق افتاده، پارچه نخى مرطوبى را روى قسمت براق شده قرار دهید و اتو بکشید، تا بخار حاصله برق افتادگى را از میان ببرد.
اثر سوختگی با اتو :
اگر لباس شما بر اثر گرمای زیاد اتو زرد رنگ شده می توانید پیاز را دو نیم کرده و روی پارچه بمالید و بعد آن را داخل آب سرد به مدت چند دقیقه خیس کرده و سپس آن را بشویید. خواهید دید که لکه های زرد برطرف می شود.
نحوه از بین بردن لکه اتو روی فرش :
همچنین برای از بین بردن لکه اتو بر روی فرش و موکت همانند لباس می توانید یک پیاز را به دو نیم کرده و روی محل لکه بگذارید. بعد آن را با سرد خیس کنید و بشویید.
نحوه از بین بردن لکه چایی روی فرش :
آیا می دانید لکه چایی که روی فرش رنگ روشن ریخته و همان لحظه پاک نکرده و الان هم خشک شده است را چگونه می توان از بین برد؟
به محض ریخته شدن چای بر روی فرش، آن را با آب سرد و مواد شوینده شست و شو دهید.
اگر امکان شست وشوی سریع آن وجود نداشت، مقداری نمک روی سطح لکه بریزید و مدتی صبر کنید تا نمک آن را به خود جذب کند. سپس در صورت فراهم شدن شرایط شست وشو، آن را به روش معمول با آب گرم و مواد شوینده بشویید.
راه کار دیگر این است که سطح لکه را با اسپری مخصوص مو بپوشانید، سپس یک قطعه صابون بر روی سطح لکه بمالید و بعد آن را در آب سرد خیس کنید و بشویید.
پاک کردن لکه های زرد روی یخچال :
هنگامی که لکه هایی روی یخچال به رنگ زرد ایجاد شده و با هیچ مایع پاک کننده ای رفع نمی شود در آن هنگام کمی پنبه را به سرکه آغشته کنید و با آن روی لکه های زرد رنگ بکشید. بگذارید کمی بماند بعد با یک ابر تمیز روی آن را بکشید. سریعاً پاک می شود.
پاک کردن لکه آدامس :
گاهی اوقات برایتان اتفاق افتاده که آدامسی به لباس شما بچسبد. برای حل این مشکل می توان از راه های زیر استفاده نمود :
1- در مرحله اول می توانید یک تکه یخ روی لکه بگذارید و بعد آدامس سفت شده را بکنید.
2 -اگر پارچه شما قابل شستشوست، کمی سفیده تخم مرغ روی آدامس بمالید تا نرم شود و تا جایی که ممکن است آدامس را از روی پارچه بردارید و سپس بشویید.
3- اما اگر پارچه شما قابل شستشو نمی باشد با یک تکه اسفنج ابتدا تتراکلرید کربن و سپس آب و صابون بمالید، این عمل را تکرار کنید تا پاک شود.
برچسبها:
مرگ با سیانور !

پتاسیم سیانید یک ترکیب معدنی با فرمول KCN می باشد. این ترکیب به صورت کریستال های بی رنگ است که بیشتر به شکر شباهت دارد و به شدت در آب انحلال پذیر می باشد.
اغلب KCN در معادن طلا برای استخراج، سنتزهای آلی و آبکاری مورد استفاده واقع می شود. البته این ترکیب کاربردهای کمتری نیز در جواهرسازی برای طلاکاری و زراندود کردن به طریق شیمیایی دارد.
KCN به شدت سمی می باشد. بلور جامد نمدار و مرطوب KCN مقادیر کوچکی از هیدروژن سیانید را به علت هیدرولیز آزاد می کند که بویی شبیه به مغز بادام تلخ دارد. البته هیچ کس نمی تواند این بو را استشمام کند. در واقع توانایی انجام این کار یک خصیصه ژنتیکی و ارثی به شمار می آید. KCN توسط حشره شناسان به عوان عامل شدیدا کشنده در از پای درآوردن حشرات در ظرف چند ثانیه به کار می رود.
روش های تولید :

KCN به علت برخورد هیدروژن سیانید با پتاسیم هیدروکسید تولید می شود:
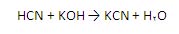
یا به وسیله ی برخورد فرمآمید با پتاسیم هیدروکسید تولید می گردد:
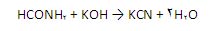
KCN تقریبا سالانه به اندازه ی 50،000 تن تولید می شود.
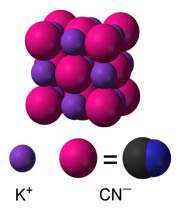
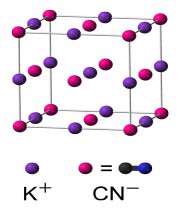
ساختار KCN :
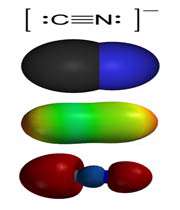
در محلول های آبی، KCN به یون های +K و -CN تجزیه می شود. در حالت جامد، کریستال های نمکی KCN شبیه کاتیون ها و آنیون های +Na و - Cl در نمک NaCl می باشند. در این جا کاتیون ها و آنیون ها شش ظرفیتی هستند.
چون - CN در این جا دو اتمی است بنابراین تقارن جامد در KCN کمتر از NaCl می باشد. در جامد KCN ، یون های - CN در دمای محیط به سرعت در حال چرخش هستند طوری که به نظر می رسد شکل متوسط یون های - CN کروی می باشد.
کاربرد ها :
- در معادن طلا برای استخراج طلا مورد استفاده قرار می گیرند. KCN و NaCN ، نمک های انحلال پذیر در آب را از فلز طلا در حضور هوا تشکیل می دهند.
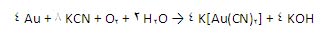
البته روش های جایگزین دیگری برای این فرایند استخراجی نیز وجود دارد.
- KCN و NaCN به طور گسترده در سنتزهای آلی جهت تهیه نیتریل ها و کربوکسیلیک اسیدها کاربرد دارند.
در کل سیانید ها عامل بازدارنده ی قوی در تنفس سلولی محسوب می شوند.
عملکرد سیانور در بدن :

این که چگونه پتاسیم سیانید یا قرص سیانور موجب مرگ می شود همچنان به عنوان یک راز بزرگ باقی مانده است. اما آیا زمانی که فرد این قرص را مصرف می کند چه اتفاقاتی در بدن او ایجاد می گردد؟ و چه عواملی سبب می شود تا فرد فورا بی هوش و در ظرف 10 الی 15 دقیقه بمیرد؟
احتمالاتی وجود دارد که نشان می دهد بعد از ورود قرص به بدن از طریق دهان، پتاسیم سیانید با آب موجود در مایع متحرک بدن( سیال ) برای تشکیل هیدروسیانیک اسید واکنش می دهد. سپس این اسید به درون مویرگ های خونی موجود در فضای زیر زبان و مویرگ های مری و به سرعت به روده نفوذ می کند. بنابراین دلیل اول این که، در مسیر جریان خون این مواد شیمیایی در سلول های قرمز خونی مانع از جذب اکسیژن می شوند و این سلول ها عملا در شرایط قحطی اکسیژن واقع می گردند که این عمل منجر به اختلال و بی نظمی در سوخت و ساز و یا متابولیسم سلولی می شود.
اما دلیل دوم، این مواد شیمیایی بعد از واکنش با آهن و یا هر نوع فلز موجود در خون ترکیبات سنگینی را تشکیل می دهند و بدین وسیله موجب کاهش سیالیت و روان کنندگی مایع سلولی و خون می شوند.
بنابراین دو فاکتور مذکور در نهایت منجر به بیهوشی و سپس مرگ در شخص می شوند. مرگ و میر با پتاسیم سیانید در حدود 95 درصد می باشد. البته اگر یک پادزهر گوگردی به موقع استفاده شود می تواند موجب نجات فرد گردد. اما با این حال فردی که زنده می ماند دچار معلولیت سیستم عصبی مرکزی به مانند بیماری پارکینسون می شود.
برچسبها:
آنتی اکسیدان ها
رادیکال های آزاد، اتم ها یا گروهی از اتم ها هستند که دارای الکترون های فرد و یا جفت نشده می باشند و می توانند زمانی که اکسیژن با مولکول های مشخص واکنش می دهد، تشکیل شوند.
زمانی که این رادیکال ها تشکیل می گردند، چون به شدت واکنش پذیر هستند می توانند آغاز کننده ی یک واکنش زنجیره ای باشند مثل دومینو ها. در واقع خطر اصلی آن ها از زمانی شروع می شود که می توانند با اجزای سلولی مهم مانند DNA و یا غشای سلولی وارد واکنش شوند.
در این حالت سلول ها ممکن است به طور ضعیف عمل کنند و یا به طور کلی در اثر این رخداد دچار مرگ سلولی شوند. برای جلوگیری از آسیب های رادیکال های آزاد به روی بدن یک سیستم دفاعی تحت عنوان آنتی اکسیدان ها وجود دارد.

آنتی اکسیدان ها مولکول هایی هستند که می توانند به شکلی آرام با رادیکال های آزاد واکنش دهند و واکنش های زنجیره ای را پایان بخشند پیش از این که مولکول های بدن تخریب گردند. اگرچه چندین سیستم آنزیمی در بدن وجود دارد که می تواند رادیکال های آزاد را حذف کند اما ترکیبات اصلی و مغزی دیگری نیز وجود دارند که به مقدار خیلی کم برای بدن لازم می باشند که همان ویتامین ها هستند.
ویتامین ها در واقع آنتی اکسیدان هایی هستند که بیشتر در سه دسته ی ویتامین E، ویتامین C و بتاکاروتن ها جای می گیرند. علاوه بر این، سلنیوم فلزی است که می تواند یک عامل مناسب به مانند یکی از همان سیستم های آنتی اکسیدانی بدن باشد که گاهی اوقات جزو این سه دسته قرار می گیرد. اما بایستی توجه داشت که بدن نمی تواند این مواد مغذی را تولید کند بنابراین ویتامین ها بایستی در رژیم غذایی مورد استفاده قرار گیرند.
شاید بدین خاطر است که گفته می شود همراه با خوردن کباب، سماق نیز استفاده شود. چون کباب، رادیکال آزاد تولید می کند و سماق با دارا بودن خاصیت آنتی اکسیدانی می تواند اثر آن را از بین برد.
ویتامین d) E- آلفا تو کو فرول):

یک ویتامین قابل حل در چربیست که در آجیل، دانه ها، سبزیجات و روغن ماهی، تمام حبوبات( بویژه ریشه ی گندم )، غلات مستحکم و زردآلو وجود دارد.
ویتامین C (اسید آسکوربیک):

یک ویتامین قابل حل در آب است که در مرکبات و آب میوه ها، فلفل سبز، کلم، اسفناج، کلم بروکلی، کلم پیچ، طالبی، کیوی و توت فرنگی وجود دارد. مقدار توصیه شده ی ویتامین برای مصرف روزانه (RDA )، شست میلی گرم در روز می باشد که مقدار بالاتر از 2000 میلی گرم می تواند اثر معکوس در بدن بعضی از افراد ایجاد کند.
بتاکاروتن :

بتا کاروتن یک پیش ماده برای ویتامین A ( رتینول ) می باشد که در جگر، زرده تخم مرغ، شیر، کره، اسفناج، هویج، شربت نارنج، کلم بروکلی، سیب زمینی هندی (شیرین)، گوجه فرنگی، طالبی، هلو و حبوبات وجود دارد. بتا کاروتن توسط بدن به ویتامین A تبدیل می شود. توجه داشته باشید که ویتامین A هیچ خاصیت آنتی اکسیدانی ندارد و اگر به مقدار بیش از حد وجود داشته باشد، کاملا سمی است.
برچسبها:
الماس مصنوعی

الماس یک جامد سخت روشن است که متشکل از شبکه ی کووالانسی اتم های کربن می باشد. الماس های مصنوعی بیشتر از گرافیتی ( یکی از سه شکل کریستالی کربن ) که در معرض دما و فشارهای خیلی بالا باشد، حاصل می شوند.

بیشتر خواص بنیادی الماس های خالص در الماس های مصنوعی بر جای مانده است. برای مثال، الماس های مصنوعی سختی زیاد، شفافیت گسترده، هدایت حرارتی بالا و مقاومت الکتریکی بالایی نیز دارند.

ساخت الماس مصنوعی یک فرآیند گران قیمت و پرهزینه می باشد. بنابراین اکثر الماس های مصنوعی به صورت کریستال های کوچک تولید می شوند که برای تهیه ی پوشش های سخت جهت تجهیزات صنعتی مثل تراش رل ماشین (چرخ)، ابزار تراش کاری، اره های حفاری و مته های معدن کاری مورد استفاده قرار می گیرند.

الماس های مصنوعی از اوایل دهه ی 1950 مورد بررسی و تحقیق قرار گرفتند. اولین شخصی که روی این مسئله مطالعه کرد، یک فیزیکدان آمریکایی به نام پرسی ویلیامز برگمن ( Percy Williams Bridgman ) بود.

تحقیقات او شامل بررسی های بسیار هزینه بر روی موادی بود که در معرض فشار بالا قرار داشتند. البته او سرانجام توانست جایزه نوبل فیزیک را به خاطر دستاوردش از آن خود کند اما در شرایطی که واقعا نتوانست الماس مصنوعی را به شکل حقیقی سنتز کند.
در دسامبر 1954، یک دانشمند از گروه جنرال الکتریک توانست پودر سیاه کربن را تحت فشار 50،000 اتمسفر برای 16 ساعت به دو تکه ی کوچک الماس سنتزی تبدیل کند.

البته باید توجه داشت که فشار استفاده شده برای ساخت الماس های مصنوعی با دما تغییر می کند. بنابراین هیچ عدد واحدی برای فشار مورد نیاز جهت تولید الماس مصنوعی وجود ندارد.

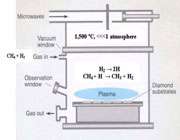
همان طور که می دانید الماس های طبیعی در فرآیند های زمین شناسی حاصل می شوند، اما الماس های مصنوعی به صورت دو روش الماس HPHT و یا روش الماس CVD سنتز می گردند.
منظور از روش HPHT ، سنتز به صورت فشار بالا و دما بالا می باشد و در CVD به صورت رسوب بخارات شیمیایی صورت می گیرد.
برچسبها:
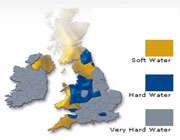
سختی آب و انواع آن

سختی آب کیفیتی است که بر اثر وجود بیش از اندازه نمک های محلول کلسیم و منیزیم و تا اندازه ای آهن، منگنز، آلومینیوم و روی در آن پدید می آید و سبب می شود که مصرف آب به طور کلی و به ویژه در صنعت دشواری هایی به وجود آورد.
درجه سختی آب :
درجه سختی آب کیفیتی است که میزان سختی آب را مشخص می سازد. درجه سختی آب به طور کلی بر حسب میلی گرم کربنات کلسیم در هر لیتر آب بیان می شود. یعنی 1 درجه سختی آب برابر 1 میلی گرم کربنات کلسیم است. اما در کشورهای مختلف، مقدار یک درجه سختی آب با هم تفاوت دارد. برای نمونه:
- یک درجه سختی آب در فرانسه، برابر 10 میلی گرم کربنات کلسیم در هر لیتر آب در نظر گرفته می شود.
- یک درجه سختی آب در انگلستان، برابر 14.3 میلی گرم کربنات کلسیم در هر لیتر آب در نظر گرفته می شود.
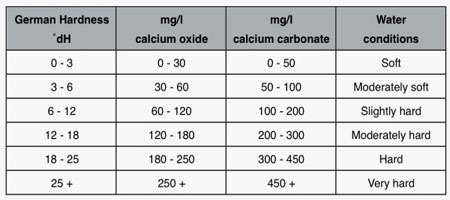
- یک درجه سختی آب در آلمان برابر 10 میلی گرم کربنات کلسیم در هر لیتر آب می باشد.
- یک درجه سختی آب در آمریکا، برابر 17.2 میلی گرم کربنات کلسیم در هر لیتر (یا یک گرم کربنات کلسیم در یک گالن، 3.785 لیتر) آب برآورد می شود.
امروزه، یک واحد همگانی برای درجه سختی آب وضع شده است که برابر 1 میلی اکی والان کربنات کلسیم (یا 50 میلی گرم کربنات کلسیم) در هر لیتر آب است.
در برخی از کشورها، از جمله آمریکا و آلمان، امروزه درجه سختی آب را بر جسب ppm بیان می کنند.
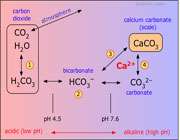
مفهوم سختی کربناتی و غیر کربناتی :
سختی کربناتی، بخشی از سختی آب است که به وجود کربنات ها و بی کربنات های کلسیم، منیزیم، آهن و ... در آن مربوط است.
سختی غیر کربناتی، بخشی از سختی آب است که از نمک های انحلال پذیر دیگر غیر از کربنات ها و بی کربنات ها یعنی سولفات ها، کلرید ها، نیترات های کلسیم، منیزیم، آهن ... موجود در آب ناشی می شود.
مفهوم سختی موقت، سختی دائم و سختی کل آب :

سختی موقت آب، بخشی از سختی آب است که از وجود بی کربنات های کلسیم، منیزیم، آهن در آن ناشی می شود و تنها با عمل جوشاندن می توان آن را برطرف کرد.
سختی دائم آب به وجود نمک هایی غیر از بی کربنات فلزهای موجود در آب مربوط است و با عمل جوشاندن آب از بین نمی رود، بلکه برای از بین بردن آن باید از مواد شیمیایی مناسب استفاده کرد.
مجموع سختی موقت و سختی دائم را، سختی کل آب می گویند. آبی که سختی کل آن از یک میلی اکی والان کربنات کلسیم کم تر باشد، آب نرم (شیرین) محسوب می شود.
برچسبها:
آشنایی با نحوه یافتن مسیر های هوایی
هواپیماهای مدرن بسیار سریع و در ارتفاع بالا پرواز می کنند، لذا خلبان نمی تواند با مشاهده سطح زمین مسیر خود را بیابد. این هواپیماها عموماً بر فراز ابرها پرواز می کنند و هیچ دیدی به سطح زمین ندارند. به همین دلیل خلبان و بخش کنترل ترافیک هوایی برای کنترل هواپیما و مسیر یابی به سیستم ها الکترونیکی نیاز دارند. این تجهیزات برای مسیر یابی از اطلاعات تجهیزات رادیویی هواپیما، تجهیزات موجود روی زمین و اطلاعات به دست آمده از ماهواره های در حال چرخش در مسیر زمین استفاده می کنند.
پیش از پرواز، خلبان نقشه پرواز را که شامل مسیر، ارتفاع و سرعت هواپیما می باشد به واحد کنترل ترافیک می دهد. واحد کنترل ترافیک هوایی، به هر هواپیما یک مسیر نامرئی برای پرواز اختصاص می دهد تا در آن پرواز نماید. با این کار هواپیماها با فاصله از هم پرواز خواهند نمود و به هم بر خورد نخواهند نمود.
در تمام فرودگاه ها برج های مراقبت وجود دارند و خلبان از این برج ها جهت پرواز راهنمایی می گیرد.
هواپیماها برای ایمنی باید حداقل 16 کیلو متر از کنار، 300 متر از بالا و پایین و به اندازه 10 دقیقه پرواز از جلو و عقب با هم فاصله داشته باشند.
اکثر هواپیماها دارای یک رادار در دماغه خود می باشند که وجود شرایط بد جوی یا وجود هواپیما و اشیاء دیگر در جلوی هواپیما را به خلبان اعلام می کند.
این رادارها امواج کوتاه رادیویی منتشر می کنند.
با برخورد این امواج به موانع یا ابرها، سیستم بازتاب می یابند و گیرنده هواپیما با توجه به شدت و زمان برگشت موج، مانع و فاصله آن را تشخیص می دهد. برای مثال زمان بازگشت یک موج برای یک مانع با فاصله 300 کیلو متر، تنها 500/1 ثانیه می باشد. اطلاعات به دست آمده از این رادار در صفحه نمایش خلبان نشان داده می شود.
در نواحی بالای فرودگاه هواپیماها توسط واحد کنترل ترافیک هوایی راهنمایی می شوند. این واحد از طریق رادیو با خلبان صحبت می کند.
اطلاعات مربوط به تمامی هواپیماها از طریق رادارها فرودگاه بر روی صفحه نمایش های واحد کنترل ترافیک هوایی ثبت می گردد.
برچسبها:
















 آمار
وب سایت:
آمار
وب سایت:

