نیرو: چرا ماه به دور زمین می چرخد؟!

پس از افتادن سیب روی زمین ایزاک نیوتن، تحقیقات زیادی انجام داد و در پایان نتایج خود را این چنین اعلام کرد.
در این جا با ذکر یک مثال به بررسی قانون کنش و واکنش می پردازیم :
اگر به کتابی روی میز نیرو وارد شود، میز نیز به همان مقدار به کتاب نیرو وارد می شود به همین دلیل است که کتاب در جای خود باقی می ماند، نه در میز فرو می رود و نه به طرف بالا حرکت می کند.
در این قسمت به بررسی این خواهیم پرداخت که آیا با قوانین نیوتن می توان حرکت اجرام آسمانی را بررسی کرد یا خیر؟!
در آسمان ها، اجسام آسمانی در خلأ حرکت می کنند امّا مسیر آن ها در یک خط مستقیم نمی باشد، مثلا ً ماه در یک مسیر منحنی دور زمین می چرخد؛ این واقعیت با قوانین نیوتن مغایرت ندارد؛ زیرا ماه به حال خود گذاشته نشده است.
ماه همواره به طرف زمین کشیده می شود، در واقع نیروی گرانش زمین ماه را به سمت خود جذب می کند.
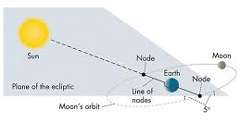
نیوتن چنین اعلام کرد که چنان چه فرض کنیم نیروی جاذبه ی زمین روی سیب اثر می کند، روی ماه هم تأثیر می گذارد. پس می توانیم چگونگی حرکات ماه را به خوبی توضیح دهیم.
نیوتن هم چنین توانست نشان دهد که مقدار نیروی جاذبه میان دو جسم در جهان، به جرم آن دو جسم و مقدار فاصله ی آن ها از یک دیگر بستگی دارد.
یعنی هر چقدر جرم جسمی بیشتر باشد، نیروی جاذبه ی بین آن ها بیشتر می شود و هر چقدر که فاصله ی بین دو جسم بیشتر باشد، نیروی جاذبه کمتر می شود.
با این قانون، نیوتن چگونگی حرکت اجسام آسمانی را تقریباً به جزئیات کاملی توضیح داده این قانون نشان داد که چرا زمین، به آرامی به دور محور خود می چرخد که نتیجه نهایی این حرکت شب و روز می باشد.
نیوتن اعلام کرد که تصور ارسطو اشتباه است زیرا تنها یک قانون طبیعی بر آسمان ها و زمین وجود دارد و نه دو قانون طبیعی.

در پایان می توان گفت که سه قانون حرکت نیوتن همان طور که افتادن سیب و جهش توپ را توضیح می داد، حرکت دایره وار ماه را نیز روشن می کرد.
بنابراین، نیوتن ثابت کرد که آسمان ها و زمین بخش هایی از یک جهان هستند.
برچسبها:
تعادل 4

کنترل یک واکنش:
در مطالب قبل به ویژگی های سیستمهای در حال تعادل اشاره کردیم و با ثابت تعادل آشنا شدیم...
حال میخواهیم بدانیم آیا میتوانیم واکنش را به دلخواه خودمان کنترل کنیم؟
جواب مثبت است!
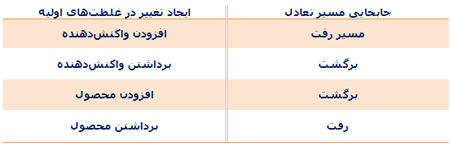
برای اینکه محصول بیشتری تولید کنیم و یا بازده واکنش را بالا ببریم، میتوانیم تغییرات زیر را در سیستم واکنش ایجاد کنیم:

- تغییر غلظتهای واکنش دهندهها یا محصولات
- تغییر دما
- تغییر فشار و حجم (برای یک واکنش در فاز گازی)
در واکنشهای تعادلی، هر تغییری در سیستم صورت گیرد، سیستم سعی خواهد کرد به سمتی پیش رود که باز هم حالت تعادل را برقرار کند. تغییرات ذکر شده در بالا نیز حالت تعادلی سیستم را به طور موقت بر هم می زنند.
اصل لوشاتلیه:
حالت تعادل در هر سیستمی به عوامل موجود در سیستم مانند دما، فشار و غلظت اجزای مختلف بستگی دارد. این عوامل، پارامتر یا متغیرهای واکنش نامیده میشوند.
یک تغییر در هر کدام از پارامترهای واکنش، ممکن است وضعیت تعادلی سیستم را تحت تأثیر قرار دهد.
قاعدهی کلی که میتواند تأثیر تغییرات این پارامترها را بر روی حالت تعادل توصیف کند، توسط اچ. لوشاتلیه (1885) و اف. بارون (1886) فرمولبندی شده ولی به طور مشترک، اصل لوشاتلیه نامیده میشود.
این اصل، کاربرد سودمند بزرگی برای تمام سیستمهای فیزیکی و شیمیایی دارد.
این اصل بیان میکند هر سیستمی که در معرض تغییری در پارامترهای خود قرار میگیرد، فرایندهایی در سیستم اتفاق میافتد که با تغییر اولیه مخالفت کنند؛ بنابراین سیستم به یک وضعیت تعادلی جدید میرسد.
تغییر غلظت واکنشدهندهها یا محصولات:
یک سیستم شیمیایی در حال تعادل در نظر بگیرید. اگر تعادل با تغییر غلظت هر کدام از اجزای واکنش به هم بخورد، تعادل به جهتی انتقال پیدا خواهد کرد که سعی در برگرداندن سیستم به وضعیت اصلیاش خواهد کرد. به مثال زیر توجه کنید:
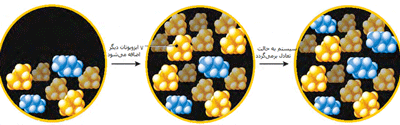
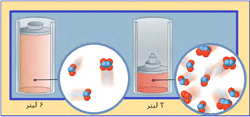
سیستمی از مخلوط 5 مولکول ایزوبوتان و 2 مولکول بوتان در حال تعادل است. با اضافه کردن هفت ایزوبوتان دیگر، سیستم از حالت تعادل خارج میشود.
شبکهای از دو مولکول ایزوبوتان به مولکول بوتان تغییر میکند تا بازهم مخلوطی به دست آید که حالت تعادلی برقرار شود. نسبت ایزوبوتان به بوتان، 5 به 2 است.
در واکنش زیر، افزودن BaCl2 باعث جابجاشدن مسیر تعادل در مسیر رفت خواهد شد تا وضعیت تعادلی جدید برقرار شود:
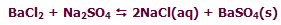
در واکنش زیر افزودن Cl2 به حالت تعادل سیستم، باعث جابجا شدن مسیر تعادلی سیستم در جهت برگشت خواهد شد:
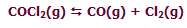
به نظر شما با این افزایش Cl2 چه اتفاقی برای غلظت CO خواهد افتاد؟
اثر حجم:
اگر یک سیستم گازی متراکم شود، فشار افزایش پیدا میکند و باعث میشود سیستم با یک شیفت (جابجایی) در جهت مولکولهای گازی کمتر تا اندازهای از فشار و تغییر ایجاد شده رهایی پیدا کند.
در حالتی که سیستم منبسط شود، فشار کاهش پیدا میکند و یک شیفت در جهت مولکولهای گازی بیشتر تا اندازهای به حالت تعادلی اولیه باز میگردد.
در شکل بالا، گاز N2O4 با NO2 در حال تعادل است:
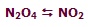
ابتدا نسبت N2O4 به NO2، مقدار 1 به 2 است (1:2) . سپس حجم سیستم به یک سوم حجم اولیه کاهش مییابد (سیستم متراکم میشود) و برای اینکه سیستم به تعادل دوباره برسد، واکنش به سمتی جابجا میشود که این فشار افزایش یافته را کم کند (جهتی که تعداد مولکولها را کاهش دهد)؛ بنابراین تعادل دوباره برقرار میشود (نسبت N2O4 به NO2 اکنون 4:5 است).
جابجایی مسیر تعادل با تغییر دمای سیستم:
با یک مثال این بحث را شروع میکنیم؛ زمانی که یک مول گاز استیلن با دو مول گاز هیدروژن واکنش نشان دهد، یک مول گاز اتان تشکیل میشود و 311 کیلوژول انرژی آزاد میکند؛ بنابراین یک واکنش گرماده است.
|
گرما، محصول دیگر این واکنش است: |
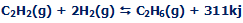 |
ΔH=-311KJ به معنای آزاد شدن 311 کیلوژول انرژی گرمایی از این واکنش است.
- در واکنشهای گرماده که با فرمول کلی:
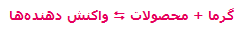
مشخص میشوند، افزودن گرما و حرارت دادن به سیستم باعث جابجایی مسیر تعادل در جهت برگشت میشود (یعنی واکنش دهندهی بیشتر). به همین ترتیب، برداشتن حرارت و گرما از سیستم باعث جابجایی تعادل در مسیر رفت میشود (تا محصول بیشتری تولید کند).
به مثال زیر توجه کنید:
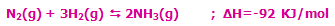
با کاهش دمای سیستم در این واکنش گرماده (برداشتن حرارت از سیستم)، مسیر رفت واکنش تعادلی، پیشرفت میکند تا محصول بیشتری تولید شود!
- در واکنشهای گرماگیر که با فرمول کلی:

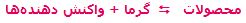
مشخص می شوند، افزودن حرارت به سیستم باعث جابجایی و شیفت تعادل به سمت رفت واکنش می شود (محصول بیش تری تولید می شود) و برداشتن حرارت و کم شدن دمای سیستم باعث شیفت تعادل به سمت برگشت می شود (واکنش دهنده ی بیش تر). به مثال زیر توجه کنید:
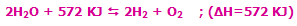
با افزایش دمای سیستم در این واکنش گرماگیر، واکنش در جهت رفت پیش میرود تا اکسیژن و هیدروژن بیشتری تولید کند.
برچسبها:
تعادل 3

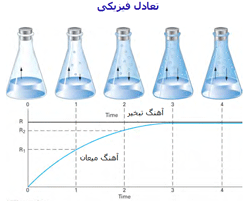
تغییرات آهنگ واکنش در هنگام نزدیک شدن واکنش به حالت تعادل:
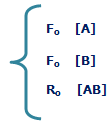
به شکل زیر توجه کنید؛ در لحظهی t=0 مقدار زیادی از مولکولهای A و B وجود دارد (در t=0 محصول AB تشکیل نشده است) و واکنش رفت سریع است (آهنگ واکنش رفت با Fo نشان داده میشود) و واکنش برگشت اتفاق نیفتاده است (آهنگ واکنش برگشت با Ro نشان داده میشود).
با گذشت زمان، AB تشکیل میشود و A و B مصرف میشوند، بنابراین طبیعی است که آهنگ رفت و برگشت تغییر کند. هر چه زمان میگذرد، واکنش رفت کندتر شده (A و B کمتری باقی مانده) و واکنش برگشت سرعت میگیرد (مولکولهای AB بیشتری تولید شده است).
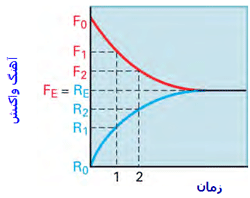
آهنگ واکنش:
در حالت تعادل، آهنگ واکنش رفت و برگشت دقیقاً با هم مساوی خواهند بود:
 |
 |
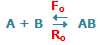 |
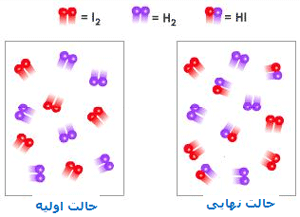
به عنوان یک مثال از بحث قبلی، واکنش گاز هیدروژن با گاز ید را در نظر میگیریم:
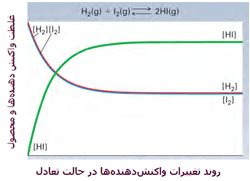
این دو گاز برای تشکیل یدید هیدروژن (HI) با هم وارد واکنش میشوند. هنگامی که سیستم به تعادل میرسد، آهنگ واکنش رفت و برگشت کاملاً با هم برابر میشوند و غلظت نسبی HI، H2 و I2 ثابت باقی میماند. در حالت تعادل، مقدار HI از H2 و I2 بیشتر است. در شکل زیر، روند این واکنش را مشاهده میکنید.
منظور از [HI] غلظت مولکولهای HI در واکنش است.
ثابت تعادل:
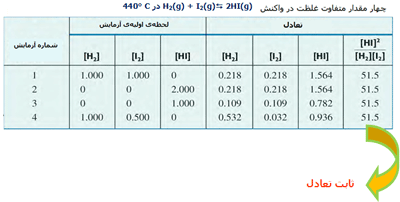
در واکنش ید و هیدروژن و تشکیل یدید هیدروژن، مقادیر نسبی HI، I2 و H2 در سیستمهای تعادلی مختلف با ثابت تعادل واکنش تعریف میشود. این مقادیر در جدول زیر آمدهاند.
حال ببینیم چگونه میتوان ثابت تعادل را محاسبه کرد؟
برای هر واکنش شیمیایی در یک دمای معین، نسبت حاصلضرب غلظت اجزای سمت راست واکنش که هر کدام از آنها به توان ضریب خود (تعداد آن محصول) میرسد، به حاصلضرب غلظت اجزای سمت راست واکنش که آنها نیز به توان ضریب خود میرسند، مقدار ثابتی دارد که به آن ثابت تعادل (K) گفته میشود.
در واکنش زیر، محاسبهی ثابت تعادل با استفاده از روش ذکر شده بدین صورت خواهد بود:
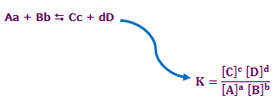
K ثابت تعادل واکنش بوده و مستقل از دما و نوع واکنش است.
به عنوان مثال محاسبهی ثابت تعادل واکنش، معادلهی زیر را در نظر میگیریم:
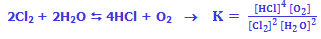
مواد واکنش دهندهی جامد و مایع در اکثر واکنشهای شیمیایی، غلظتهای ثابتی دارند و در محاسبهی K از آنها صرفنظر میشود:
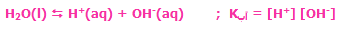
مقدار ثابت تعادل اطلاعات جالبی راجع به غلظت مواد درگیر واکنش و مورد توجه بودن واکنش رفت یا برگشت به ما می دهد؛ به عنوان مثال وقتی می گوییم مقدار K یک واکنش 1 * 109 است، یعنی غلظت محصولات به طور چشم گیری بیش تر از غلظت واکنشدهنده هاست ( 109 * 1 برابر غلظت واکنش دهنده ها است). برای نمکهایی که به سختی در آب حل می شوند، KSP تعریف می شود که ثابت حاصلضرب انحلال پذیری نام دارد.
مقدار K هر چه که باشد، میتوان آنرا اینگونه تفسیر کرد:

وقتی [ محصولات ] > [ واکنشدهندهها ] و K بزرگ است:
- واکنش، تشکیل محصولات را آسان میکند.
- واکنش در جهت رفت پیشرفت کرده است.

وقتی [ واکنشدهندهها ] > [ محصولات ] و K کوچک است:
- واکنش، تشکیل محصولات را آسان میکند.
- واکنش در جهت برگشت پیشرفت کرده است.

وقتی K از 0.1 تا 10 تغییر میکند و [ محصولات ] تقریبا مساوی با [ واکنشدهندهها ]:
- مقادیر قابل توجه و محسوسی از هر دو موجود است.
در تمام موارد بالا، سیستم در حالت تعادل قرار دارد.
برچسبها:
تعادل 2:
در مطلب قبل به شرایط تعادل و انجام واکنشهای شیمیایی اشاره شد. حال ببینیم فراهم شدن شرایط واکنش، گویای کدام خاصیت فیزیکی مواد است و چه عواملی، انجام سریعتر و بهینهتر واکنشهای مواد را تحت تأثیر قرار میدهند؟
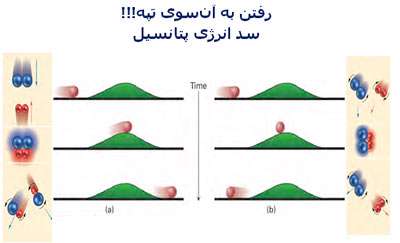
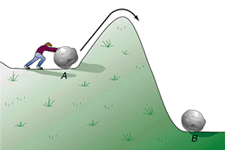
در شکل بالا به خوبی دیده میشود که برای این که واکنشی صورت پذیرد، شرایط لازم برای آن (تعداد و جهت مناسب ذرات واکنش دهنده و انرژی جنبشی کافی آن ها) چگونه تشکیل محصولات را تحت تأثیر قرار می دهد.
در حالت (a) سیستم، انرژی کافی برای رفتن به آن سوی تپه و غلبه به سد انرژی پتانسیل را دارد؛ بنابراین محصولات تشکیل میشوند.
در حالت (b) سیستم، انرژی کافی برای عبور از سد انرژی پتانسیل ندارد؛ بنابراین محصولات این برخورد ناموفق تشکیل نمیشوند.
در مطلب قبلی گفته شد که انرژی فعالسازی، حداقل انرژی لازم برای ایجاد انرژی برخورد مؤثر است تا واکنش انجام شود. با مقایسهی این مطلب و شکل قبل میبینیم که اگر شرایط انجام واکنش مهیا باشد و انرژی فعالسازی نیز کافی باشد، میتوان به سد پتانسیل غلبه کرد. به نظر شما این سد پتانسیل ناشی از چیست؟
حال ببینیم چه عواملی بر سرعت و کارایی واکنش های شیمیایی تأثیر دارند:
· دمای واکنش: با افزایش دما سرعت انجام واکنش نیز بالا می رود.
· کاتالیزگرها: کاتالیست مناسب، سرعت واکنش را بالا می برد.
· غلظت واکنش دهنده ها: غلظت زیاد واکنش دهنده ها موجب سرعت یافتن واکنش می شود.
اثر دما بر آهنگ واکنش:
در فرایند تبخیر مولکول های آب در یک ظرف در بستهی نیمه پر، مولکول ها در فضای گازی بالای آب در حال تبخیر، توزیعی از سرعت های مختلف دارند؛ برخی از این مولکول ها کند و برخی بسیار سریع حرکت می کنند.
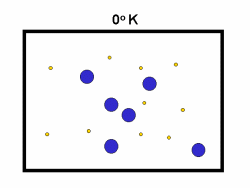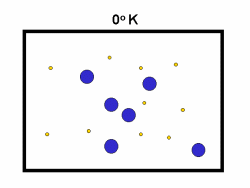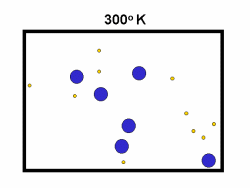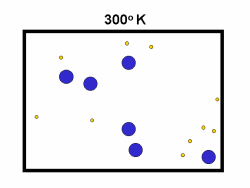
شکل بالا این مطلب را به خوبی نشان میدهد؛ دایرههای آبی، مولکولهاییاند که سرعت حرکت بالایی دارند و دایرههای قرمز، مولکول هاییاند که سرعت کمی دارند. حال ببینیم تغییر دما چه تأثیری بر روی سرعت مولکول ها دارد؟
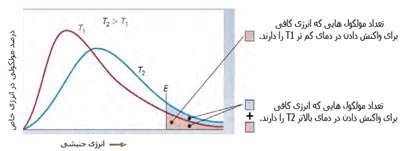
· تنها کسری از مولکولهای نشان داده شده در ناحیهی پایینی منحنی در سمت راست، انرژی جنبشی کافی برای واکنش دادن دارند.
· کسر بزرگی از مولکولها میتوانند در دماهای بالاتر واکنش دهند.
در زندگی روزمره نیز واکنشهای شیمیایی فراوانی را در همین ارتباط مشاهده میکنیم؛ به عنوان مثال، آهنگ فاسد شدن غذای منجمد شده نسبت به غذایی که در دمای عادی نگهداری میشود، کمتر است. همچنین، غذا در زودپز خیلی سریعتر از حالت عادی پختن غذا میپزد زیرا در دمای بالاتری به جوش میآید اما همین غذا اگر در منطقهای که ارتفاع بالایی نسبت به سطح دریا دارد پخته شود، دیر خواهد پخت؛ زیرا فشار پایینتر، نقطهی جوش را پایینتر میآورد.
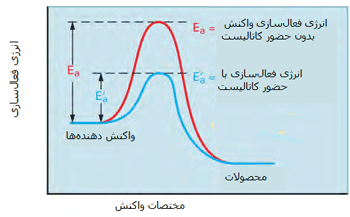
نقش کاتالیزورها در آهنگ واکنش:
مطابق شکل زیر، یک کاتالیست راهی را فراهم میکند که واکنش با انرژی فعالسازی کمتری اتفاق بیفتد؛ بنابراین بیشتر مولکولهایی که انرژی جنبشی کمتری دارند، قادر خواهند بود از سد انرژی پتانسیل عبور کنند.
در شکل دوم، کسری از مولکولها با انرژی کافی برای وارد شدن به برخوردهایی که باعث انجام واکنش میشوند، در صورت وجود کاتالیست افزایش پیدا میکند زیرا سد انرژی فعالسازی پایین میآید.
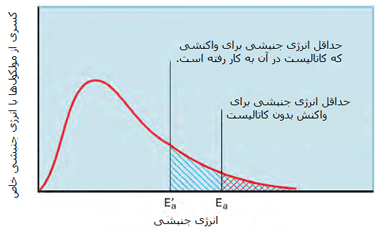
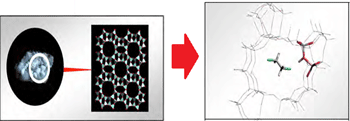
حال مثالی از نقش کاتالیست زئولیت (نوعی سیلیکات آبدار) در انجام واکنش میآوریم تا این مطلب را به خوبی درک کنید:
زئولیتها جامدهایی با شبکهی کوالانسیاند و دارای حفرهها و کانالهایی خاص هستند و مولکولهای گازی میتوانند از طریق این کانالها پخش شوند. زمانی که دو مولکول گاز درون زئولیت با همدیگر روبهرو میشوند، مجبور به نزدیک شدن به هم در یک جهت ویژه میشوند (این جهت ویژه، جهتگیری درست برای انجام واکنش است). این دو مولکول مدت طولانی را با هم میمانند و شانس بیشتری برای واکنش دارند. طبیعت کاتالیستها این است که به طور مستقیم در واکنش شرکت میکنند (اما واکنشدهنده یا محصول نیستند) و محیط مناسبی برای انجام واکنش فراهم کرده و سد انرژی فعالسازی را پایین میآورند.
تأثیر غلظت بر سرعت واکنش:
آهنگ یک واکنش به تعداد برخوردها در واحد زمان نیز بستگی دارد. هرچه تعداد ذرات موجود در حجم خاص که واکنش در آن صورت میگیرد زیاد باشد، برخوردهای متوالی بیشتری اتفاق خواهد افتاد و واکنشها با سرعت بیشتری انجام خواهند گرفت. به شکل زیر که سوختن برادهی فولاد در اکسیژن را نشان میدهد، توجه کنید:

در ردیف اول، برادهی فولاد در هوا (غلظت کم اکسیژن) حرارت داده میشود. در ردیف دوم، برادهی فولاد در اکسیژن خاص حرارت داده میشود. این مشاهده براساس توجیهات بالا کاملاً قابل درک است.
برچسبها:
تعادل 1

· تعادل چیست؟
· چگونه به سرعت میتوان به تعادل در یک واکنش شیمیایی رسید؟
· آیا دما روی تعادل و آهنگ واکنش تأثیر دارد؟
· ثابت تعادل چیست؟
· آیا تعادل روی مقدار محصولات واکنش (بازده) تأثیر دارد؟
در این مجموعه به تمامی سؤالات بالا پاسخ خواهیم داد. اما به راستی تعادل چیست؟ تعادل شیمیایی و تعادل فیزیکی چگونه حاصل میشوند؟
زمانی که یک واکنش شیمیایی شروع میشود، ابتدا واکنش دهندهها وارد عمل میشوند. رفته رفته از غلظت واکنش دهندهها کم شده و به غلظت محصولات اضافه میشود. در نهایت، زمانی میرسد که هیچ تغییری در غلظت واکنش دهندهها و محصولات مشاهده نمیشود. چنین واکنشهایی که در آنها فقط قسمتی از مقدار کلی واکنش دهندهها به محصول تبدیل میشود، فرایندهای برگشتپذیر نامیده میشوند.
تعادل زمانی است که:
- هر تغییری در طول واکنش برگشتپذیر است و میتواند با معادلهای که شامل یک فلش دوطرفه است، نشان داده شود.
- سیستم تعادلی، محصور و بسته است؛ سیستم بسته و محصور به سیستمی گفته میشود که هیچ مادهای نتواند وارد یا خارج این سیستم شود.
- در حالت تعادل، سیستم پویا است؛ گویی در مقیاس ماکروسکوپی به نظر میرسد هیچ اتفاقی نیفتاده است اما در مقیاس ریز، تغییرات برگشتپذیر به طور متوالی روی میدهند.
تعادل فیزیکی شامل تغییرات خواص شیمیایی مواد مرتبط با واکنش نیست. برای نمونه، تعادل بخار آب با خود آب در یک بطری در بستهی نیمه پر یک تعادل فیزیکی است زیرا مولکولهای آب فقط از مایع به بخار تبدیل میشوند.
تعادل شیمیایی با تغییر در ترکیب شیمیایی مواد، شکستن و تشکیل پیوند مرتبط است. یک مثال برای این تغییر، تجزیهی اسید استیک است. مبادلهی ذرات بین یونها و مولکولها در این تجزیه وجود دارد؛ زمانی که تعادل حاصل میشود، آهنگ مبادلهی ذرات بین یونها و مولکولها مساوی میشود.
مثال 1 از تعادل فیزیکی : تا مرحلهی 3، آهنگ تبخیر و آهنگ میعان کاملاً با هم متفاوتند و عمل تبخیر، بیشتر صورت میگیرد اما با گذشت زمان، میعان هم رو به افزایش است. در مرحلهی 3 و 4 آهنگ تبخیر و آهنگ میعان برای هر تغییر فیزیکی برابرند.
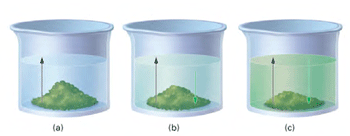 |
در حالت (c) آهنگ رفت (حل شدن مادهی جامد در حلال) و آهنگ برگشت (بلوری شدن مادهی حل شونده) در تعادل فیزیکیاند.

سؤال: در یک سیستم تعادلی، چه چیزهایی مساوی یا متعادل هستند؟
- لزومی ندارد غلظت مواد در تعادل، کاملاً مساوی باشد.
- فرایند هابر را به خاطر بسپارید (ساخت مواد خام و اولیه برای کود شیمیایی):

- در فشار و دمای اتاق، این واکنش تقریباً با هیچ NH3 در تعادل نیست.
- آهنگ تغییر در مسیر رفت واکنش (از چپ به راست معادله) با آهنگ برگشت (از راست به چپ) با هم مساویاند.
آهنگ واکنش
با استفاده از نظریهی برخورد در واکنشهای شیمیایی میتوان این مطلب را درک کرد. یک تغییر شیمیایی که به طور ماکروسکوپی قابل مشاهده است، نتیجهی تعداد زیادی از برخوردها مابین ذرات واکنش دهنده است. در شکل زیر و در حالت a، مولکولهای آبی و قرمز به دلیل اینکه انرژی جنبشی کافی و جهت مناسب دارند، واکنش انجام میگیرد. در حالت b با اینکه مولکولها جهت مناسب دارند ولی انرژی جنبشی کافی ندارند، واکنش انجام نمیگیرد. در حالت c مولکولها در برخورد با هم انرژی جنبشی کافی دارند اما جهتگیری آنها مناسب نیست؛ پس در این حالت نیز واکنش انجام نمیگیرد.
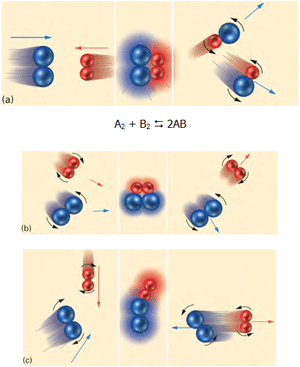
حال ببینیم تغییرات انرژی در طول واکنش به چه صورت است:
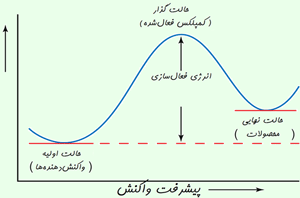
انرژی لازم برای واکنش (ΔE ) است. برای تشکیل محصولات، بایستی کمپلکسی از مجموعه ذرات فعال در واکنش با انرژی بالا نیز تشکیل شود. کمپلکس فعال شده، نوعی حالت واسطهی مولکولی است که در حین برهمکنش (برخورد) مولکولهای در حال واکنش با یک تغییر شیمیایی تشکیل میشود؛ بالاترین مقدار انرژی در حین واکنش به این حالت اختصاص دارد.
انرژی فعال سازی (Ea) کمترین انرژی جنبشی لازم برای تولید انرژی برخورد مؤثر است و با این انرژی میتوان به بالای تپه رفت!!!
در مطلب بعدی، این موضوع شرح داده خواهد شد.
برچسبها:
راه های انتقال گرما را بشناسید.
به طور کلی گرما به سه طریق همرفت، تابش و رسانایی در محیط پیرامون ما انتقال می یابد که در این مقاله توضیح مختصری در رابطه با این روش ها ارائه خواهد شد.
انتقال گرما از طریق همرفت فقط وقتی رخ می دهد که ماده سیال باشد (مایع یا گاز) تا در این مواد سیال بخش گرم ماده بتواند از بین بخش های سردتر بالا رود. سیال می بایستی از پایین گرما و یا از بالا سرد شود.

در منازل، بخاری نزدیک کف اتاق قرار دارد و این در حالی است که سرد کن یخچال های خانگی در قسمت بالای آن قرار دارند. امروزه فضای بین دیوارهای خانه را با اسفنج پر می کنند.
کلمن های مسافرتی معمولاً از اسفنج ساخته می شود. زیرا آزمایش های گوناگون نشان داده است که هوا رسانای ضعیف گرماست. 
آن گاه اگر بتوانیم هوا را در جایی گیر بیندازیم، می توانیم مانع از انتقال همرفتی گرما شویم.
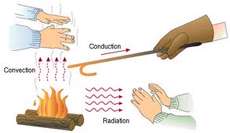
تابش :
گرما از خورشید با عبور از فضای خلأ و تهی به زمین می رسد. هر جسم داغ، حتی بدن انسان از خود اشعه هایی گسیل می کند که این گسیل ها توسط اجسام سردتر جذب می شوند. 
جالب است بدانید که گرمایی که از طریق تابش انتقال می یابد. روی خط مستقیم منتقل می شود. 
برای همین است که وقتی در هوای باز مقابل آتش می نشینیم، صورت ما از گرمای انتقالی از طریق تابش سرخ می شود، در حالی که پشت ما سرد است.
توانایی جذب گرما از طریق تابش به رنگ سطح نیز بستگی دارد. جسم سیاه هر تابشی را با سرعت و با کارایی زیاد جذب می کند. 
جسم سیاه هم چنین هنگامی که گرم است، یک تابنده ی عالی است. به همین خاطر است که پرده های خنک کننده موتور ها همواره به رنگ سیاه می باشد.

می توان با چندین آزمایش به این نتیجه رسید که جسم سفید نه جذب کننده ی خوبی است و نه تابش گر برای عایق بندی اتاق های زیر شیروانی از ورقه آلومینیومی استفاده می شود زیرا ورق آلومینیومی از تابش گرمای داخل به خارج در زمستان و از انتقال گرمای خارج به داخل در تابستان جلوگیری می کند. 
اگر قسمتی از یک میله ی آهنی راروی اجاق گاز قرار دهیم، بعد از مدتی خواهیم دید که انتهای دیگر آن نیز گرم شده است. گرما از طریق بدنه ی میله ی آهنی از انتهای داغ به انتهای سرد منتقل می شود.
شارش گرما از طریق ماده رسانش گرمایی نام دارد. فلزات رسانای خوبی برای گرما هستند و نافلزات رسانای ضعیف گرما هستند. ماهی تابه مسی گرما را به صورت یکنواخت و در تمام جهات در ته ماهی تابه پخش می کند، دسته پلاستیکی ماهی تابه نیز رسانای ضعیف گرماست و به عنوان عایق حرارتی نام گذاری شده است.
برچسبها:
نظریه ی حالت گذار
نظریه ی حالت گذار پیشنهاد می کند هنگامی که مولکول های واکنش دهنده به نزدیکی همدیگر می رسند، به طور آنی در حالتی با پایداری کم تر از پایداری حالت واکنش دهنده ها و محصولات خواهند بود.
در نظریه ی حالت گذار، مکانیسم اندرکنش واکنش دهنده ها مطرح نیست؛ معیار مهم آن است که مولکول های واکنش دهنده، انرژی کافی برای غلبه بر سد پتانسیل انرژی (انرژی فعال سازی) داشته باشند تا واکنش دهند.
در این حالت با پایداری کم تر، اتمها خود را از نو آرایش می دهند، پیوندهای اصلی ضعیف می شوند و پیوندهای جدید اندکی تشکیل می شوند.
انرژی پتانسیل سیستم در این نقطه افزایش می یابد؛ زیرا:
· مولکول های واکنش دهند هی در حال واکنش، باید به نیروهای دافعه ی متقابل بین الکترون های لایه ی بیرونی تر اتم های سازنده ی خود غلبه کنند.
· اتم ها باید هنگام شکسته شدن پیوندهایشان از هم جدا شوند.
برای یک واکنش دو مولکولی، حالت گذار هنگامی تشکیل می شود که پیوندهای مولکول های قدیمی، ضعیف می شوند و پیوندهای جدید شروع به شکل گیری می کنند یا این که ابتدا پیوندهای قدیمی می شکنند تا حالت گذار را شکل دهند و بعد از آن پیوندهای تازه تشکیل می شوند.
در مثال زیر، حالت گذار اتفاق می افتد:
رسیدن به حالت گذار، انرژی زیادی لازم دارد؛ بنابراین این حالت، مادهای با انرژی زیاد به وجود میآید. این افزایش در انرژی پتانسیل با سد پتانسیلی متناظر است که اگر واکنش به پیش رود، مولکولهای واکنشدهنده باید از آن عبور کنند.
آرایش اتمها در بیشینهی این سد پتانسیل، کمپلکس فعال یا حالت گذار نامیده میشود و یک حالت واسطهی گذرا بین واکنشدهندهها و محصولات است.
· حالت گذار یا کمپلکس فعال شده، یک حالت ترکیبی ناپایدار گذرای مولکولهای واکنشدهنده است که در یک بیشینهی انرژی پتانسیل اتفاق میافتد.
این ترکیب هم می تواند در جهت تولید محصولات به پیش رود و هم به سمت واکنش دهندههای تغییر نیافته برگردد.
· تفاوت انرژی بین واکنش دهنده ها و بیشینه ی انرژی پتانسیل به انرژی فعال سازی برمی گردد.
حرکت واکنش از روی بیشینهی انرژی پتانسیل اغلب با دیاگرام هماهنگ واکنش نشان داده می شود.
افزایش در انرژی پتانسیل با سد پتانسیلی متناظر است که اگر واکنش به پیش رود، مولکولهای واکنشدهنده باید از آن عبور کنند.

شکلهای زیر، نظریهی حالت گذار را با اشاره به واکنش بین هیدروژن و ید برای تولید یدید هیدروژن نشان میدهد:
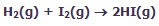
در این فرایند، مولکول های واکنشدهنده به همدیگر نزدیک میشوند و زمانی که آن ها در حین متعادلسازی واکنش برای حالت گذار یا کمپلکس فعالشده به پیش میروند:

پیوندهای اصلی ضعیف میشوند.

پیوندهای جدید نسبتاً تشکیل میشوند.
در این شکل، واکنش در حهت تولید محصول پیشرفت میکند. این شکلها را به دقت نگاه کنید تا ضعیف شدن پیوندهای اصلی و تشکیل پیوندهای جدید را بعد از تولید محصولات ببینید:
همان طور که دما افزایش پیدا می کند، سهم اجزای واکنش دهندهای که می توانند به بیشینه ی انرژی پتانسیل برسند، افزایش پیدا می کند؛ افزایش تعداد مولکول ها ی محصول که در هر ثانیه تشکیل می شوند، آهنگ واکنش را افزایش می دهد.

نکات کلیدی:
 افزایش دمایی مانند ١٠ K آهنگ واکنش بسیاری از واکنش های شیمیایی را تقریباً دو برابر می کند.
افزایش دمایی مانند ١٠ K آهنگ واکنش بسیاری از واکنش های شیمیایی را تقریباً دو برابر می کند.
نظریه ی برخورد بر پایه ی انرژی جنبشی است و فرض میکند که ذرات باید دارای دو شرط جهت مناسب و انرژی جنبشی کافی باشند تا واکنش دهنده ها به محصول تبدیل شوند.

کم ترین انرژی جنبشی لازم برای یک برخورد توسط مولکول های واکنش دهنده برای تشکیل محصولات، انرژی فعال سازی (Ea) نامیده میشود.

نسبت مولکول های واکنش دهنده ای که با انرژی جنبشی مساوی با انرژی فعال سازی واکنش می دهند، با افزایش دما زیاد می شود.

نظریه ی حالت گذار پیشنهاد می کند که هنگام نزدیک شدن مولکول های واکنش دهنده، یک کمپلکس فعال شده ی گذرا (حالت گذار) در بیشینه ی انرژی پتانسیل تشکیل می شود.

در نظریه ی حالت گذار، انرژی فعال سازی، تفاوت انرژی بین واکنش دهنده ها و بیشینه ی انرژی پتانسیل است.

در کمپلکس فعالشده، پیوندهای اصلی ضعیف شده و پیوندهای جدید نسبتاً تشکیل میشوند. کمپلکس فعالشده ممکن است در جهت تولید محصولات به پیش رود و یا به سمت واکنشدهندهها برگردد.

زمانی که دما افزایش پیدا می کند، نسبت بزرگ تری از مولکول های واکنش دهنده می تواند به بیشینه ی انرژی پتانسیل رسیده و کمپلکس فعال شده تشکیل دهند. بنابراین تعداد مولکول های محصول تشکیل شده در هر ثانیه افزایش پیدا می کند.
برچسبها:
کوسه ها

تولید مثل کوسه ها
بعضی نیز پیچک هایی دارند که به جلبک ها می چسبند.
ولی باید دانست که بیشتر کوسه ماهی ها، سگ ماهی ها و ماهی های چهار گوش تخم گذار بچه زا هستند و تخم ها را به منظور تکامل جنسی در داخل بدن نگاه داشته و بچه زنده می زایند.
در بخشی از دیواره ی رحم در جانور ماده تعداد زیادی چنبره های loops رگ های خونی تولید می کند که در برابر کیسه ی زرده و جنین قرار گرفته و تنفس جنین را تأمین می کند.
و جفت زمانی تشکیل می شود که زرده تقریباً خالی شده و رگ های خونی جنینی و مادری به منظور رساندن مواد غذایی به هم ترکیب گردد.
وقتی که بچه از تخم بیرون می آید یا زاییده می شود در همه ی گونه های کوسه ماهی شبیه پدرش است و دگر دیسی در آن ها اتفاق نمی افتد. بیشتر کوسه ماهی ها از لحاظ کالبد شناسی شبیه یکدیگرند.
ماهی چهار گوش rays دارای بدن گود شده و پشت شکمی پهن است. باله های سینه ای اش بسیار پهن شده و به سر و تنه متصل شده است.
به طوری که این ماهی ها را چنانچه از بالا نگاه کنیم به شکل دیسک به نظر می رسند سوراخ های آب ششی در سطح پهن شکم واقع است.
دم باریک و بلند است.
شمیرا ها chimaera ماهی های عجیب و مضحکی هستند.
پوست بدن آن ها بدون پولک بوده و در هر سوی بدن چهار شکاف آب شش مانند دارند که به وسیله ی یک سر پوش غشایی پوشیده شده است و دندان ها به هم چسبیده اند. (جوش خورده)
به طور کلی ماهی های غضروفی در دریاهای آزاد و آب های ساحلی و خلیج ها به سد می پرند.
بعضاً کوسه ماهی ها و ماهی های چهار گوش در رودهای بالای آب شور هم به سر می برند.

این ماهی ها همه شکاری هستند. کوسه ماهی ها شناگران خوبی بوده و شکار های متناسب با اندازه خود انتخاب می کنند.

کوسه ماهی بزرگ ممکن است خوک آبی، یا شیر دریایی را شکار کنند ولی کوسه ماهی های آفتابی، و کوسه ماهی های بالنی wohale snarks از پلانکتون plankton تغذیه می کنند.
ماهی های چهار گوش که در کف آب به سر می برند و بیشتر بی مهرگان را می خورند.
اندام های حسی
کوسه ماهی ها بیشتر به محرکات بویایی حساسند، محرکات بویایی از آبی که از دو کیسه سطحی بویایی واقع در پوزه عبور می کند دریافت می شود.

در سر تعداد زیادی لوله های حسی موجود است که به سوراخ هایی باز می شود. این سوراخ ها به اندام های حفره ای داخل شکم که دارای موهای حسی است راه دارد. 
برچسبها:
فلزات واسطه (٢)
در این مقاله سعی خواهیم کرد خواص فیزیکی فلزات واسطه مثل چگالی، دمای ذوب، دمای جوش و قدرت و استحکام و هم چنین خواص شیمیایی فلزات واسطه ای مانند تیتانیوم، وانادیوم، منگنز، آهن، کبالت، نیکل، مس و روی را مورد بررسی قرار دهیم.
(a) برخی ویژگی های فیزیکی عناصر واسطه:
معمولا گفته می شود که این عناصر به دلیل پیوند اتمی – اتمی قوی فلزی، سفت، بادوام و محکم هستند (در مقایسه با فلزات قلیایی گروه I).
رساناهای خوب گرما و الکتریسیته (این عناصر، الکترون های آزاد زیادی برای انتقال انرژی الکتریکی و گرمایی در هر اتم دارند). چکش خوارند و به راحتی به اشکال مختلف در می آیند. این عناصر، معمولا جامد ها یا مایعات درخشنده و صیقلی هستند.
(b) دمای ذوب و جوش بالا:
پیوند فلزی بین اتم ها در فلزات قلیایی بسیار قوی است. نیروی جاذبه قوی بین اتم ها فقط در دماهای بالا ضعیف می شود؛ به همین دلیل دمای ذوب و جوش این فلزات در مقایسه با فلزات قلیایی بیش تر است.

البته با این که جیوه یک عنصر واسطه است اما دمای ذوب آن به طور غیرعادی پایین است (-٣٩ o C )
مثال: آهن در ١٥٣٥ ° C ذوب شده و در ٢٧٥٠ ° C می جوشد؛ اما یک عنصر قلیایی مانند سدیم در ٩٨ ° C ذوب شده و در ٨٨٣ ° C می جوشد.
(c) چگالی بالا:
نتیجه دیگر پیوند قوی بین اتم های عناصر واسطه آن است که آن ها به صورت قوی در کنار هم نگه داشته شده اند و همین باعث چگالی بالای آن ها می شود.
برای مثال: دانسیته آهن 7/9 g /cm٣ است؛ در حالی که دانسیته سدیم 0/97 g /cm٣ است و در حالت یخ زده روی آب شناور می ماند (چگالی آب 1/0 g /cm٣ است).
|
وانادیوم
|
 اسکاندیوم
|
|
منگنز
|

کروم
|
 روی
|
نیکل
|
(d) تشکیل ترکیبات رنگی و یون ها در محلول:
این فلزات واکنش پذیری کم تری نسبت به فلزات قلیایی دارند. آن ها با سرعت کمی با آب یا اکسیژن واکنش نشان می دهند؛ بنابراین دیر زنگ می زنند.
این فلزات بیش تر از عناصر دیگر علاقه دارند هم در حالت جامد و هم محلول در حلالی مانند آب، ترکیبات رنگی تشکیل دهند. مثال هایی از رنگ های نمک های برخی فلزات واسطه در محلول های آبی در زیر نشان داده شده اند؛ اغلب این ترکیبات / یون های رنگی، ساختارهای پیچیده ای دارند و به همین علت، کمپلکس (پیچیده) نامیده می شوند:
Sc – نمک های اسکاندیوم مثل کلراید اسکاندیوم ( ScCl٣ ) بی رنگ هستند و جزو فلزات واسطه نیستند.
Ti - کلراید تیتانیوم (TiCl٣) III بنفش است.
V - کلرید وانادیوم (VCl٣) سبز روشن است.
Cr - سولفات کروم (Cr٢(SO٤)) سبز تیره است (نمک های کرومات VI زرد هستند و نمک های دی کرومات VI نارنجی اند).
Mn - ترکیبات منگنز، پتاسیم منگنات (KMnO٤) VII، ارغوانی است (نمک های منگنز II مثل MnCl٢ صورتی کم رنگ هستند).
Fe - کلرید آهن (FeCl3 ) ، به رنگ های زرد، نارنجی، قهوه ای هستند:
· ترکیبات آهن II معمولا سبز روشن هستند و ترکیبات آهن III نارنجی / قهوه ای هستند.
Co - سولفات کبالت (CoSO٤) متمایل به صورتی است.
Ni - نیکل کلراید (NiCl٣) سبز روشن است.
Cu - سولفات مس (CuSO٤) آبی پر رنگ است.
· رایج ترین ترکیبات مس به شکل بلوری یا محلول ، آبی و گاهی سبز هستند.
·در محلولی به رنگ آبی شامل یون مس Cu+٢(aq) ، این یون ساختارهای پیچیده تری دارد:
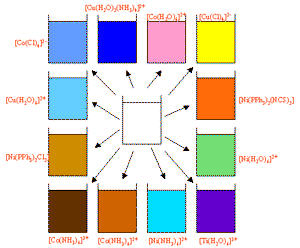
** محلول در آب [Cu(H2O)6]+2 و زمانی که محلول آمونیاک اضافه می شود.
** بعد از این که رسوب ژلاتینی آبی هیدروکسید مس (Cu(OH)٢) اولیه تشکیل می شود.
Zn - نمک های روی مثل سولفات روی ZnSO٤ معمولا بی رنگ هستند و جزو فلزات واسطه نیستند.
برچسبها:
اسید و باز لوئیس
تاریخچه: نظریهی اسید و باز لوئیس، روش جامع تری برای توصیف واکنش های بین H+ و OH- است. نظریهی اسید و باز برونستد– لوری به طور مقدماتی روی اسیدها و بازهایی که به عنوان دهندهها و پذیرندههای پروتون عمل میکنند، بحث میکند.
این نظریه میگوید: اسیدها موادیاند که در محلول، یونهای هیدروژن تولید میکنند و بازها موادیاند که یونهای هیدروکسید در محلول تولید میکنند و خنثی شدن اسید و باز زمانی اتفاق میافتد که این یونها با هم واکنش میدهند تا آب تولید کنند:

در سال ١٩٢٣ جی. ان. لوئیس نظریهای در تکمیل مفهوم اسیدها و بازها ارائه داد که توصیفی بسیار کلی از اسیدها و بازها بر روی ساختار و پیوند مواد میدهد.
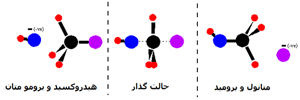
نظریهی لوئیس به جای استفاده از انتقال پروتون، از انتقال الکترونها استفاده میکند و بیان میکند که اسید لوئیس ماده ای است که یک جفت الکترون میپذیرد (مشهور به الکتروندوست) و اوربیتال خالی خواهد داشت:
مانند: BF٣، H+، Cu٢+، Cr٣+
باز لوئیس مادهای است که جفت الکترون خود را در واکنش از دست میدهد (مشهور به هسته دوست) و جفت الکترون تنها خواهد داشت:
مانند: NH٣، OH-، H٢O
واکنش اسید و باز لوئیس، پیوند کوئوردینانس کوالانسی تولید خواهد کرد؛ شکل زیر این مطلب را به خوبی نشان میدهد:

در واکنش یون هیدروکسید با یون هیدروژن، یون هیدروکسید یک جفت الکترون برای تشکیل پیوند کوالانسی میدهد، بنابراین در این واکنش، OH- باز لوئیس است. یون هیدروژن، یک جفت الکترون میپذیرد، بنابراین به عنوان اسید لوئیس عمل میکند:
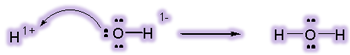
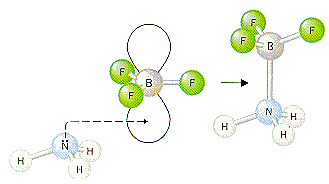
حال با مثالی دیگر از واکنش اسید و باز لوئیس توضیح خواهیم داد که هر واکنشی نمیتواند به صورت واکنش اسید و باز برونستد- لوری باشد:
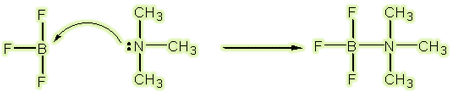
BF٣ اسید لوئیس و N(CH٣(٣ باز لوئیس است. هر دو الکترون در پیوند کوالانسی که توسط واکنش اسید و باز لوئیس تشکیل میشود، از همان اتم نیتروژن که دو الکترون خود را میدهد، تأمین میشود.
چنین پیوندهایی همان گونه که در بالا ذکر شد، پیوندهای کوئوردینانس کوالانسی نامیده میشوند. برای تأکید بر روی کوئوردینانسی بودن چنین پیوندی، اغلب از یک فلش به جای خط پیوند در ساختار لوئیس مواد استفاده میشود. جهت این فلش از اتم دهنده به سمت اتم پذیرنده است:
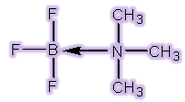
چنین محصولی که از واکنش اسید و باز لوئیس تولید می شود، ترکیب افزایشی یا به طور رایج تر، محصول افزایشی (adduct) یایون کمپلکس نامیده می شود.
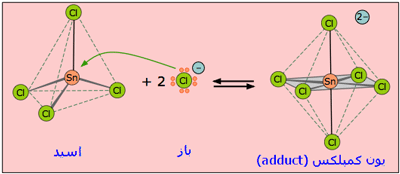
 چه موادی اسید لوئیس هستند؟
چه موادی اسید لوئیس هستند؟ اسیدهای لوئیس، به دلیل آنکه جفت الکترون میگیرند، الکتروندوست هستند؛ یعنی الکترونها را جذب میکنند.
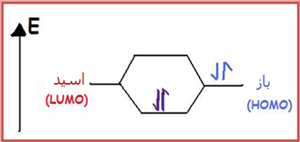
یک اسید در هنگام پیوند با یک باز از پایینترین اوربیتال مولکولی اشغالنشدهی خود (LUMO) استفاده میکند (شکل زیر).
** مواد مختلفی از جمله تمام کاتیونها اسید لوئیس هستند؛ زیرا قادر به پذیرفتن الکترونها هستند، مانند:
Cu٢+, Fe٢+, Fe٣+
** یک اتم، یون یا مولکول با آرایش الکترونی ناکامل هشتتایی (لایهی ظرفیت آنها به هشت الکترون نمیرسد) میتواند به عنوان اسید لوئیس رفتار کند، مانند:
BF٣, AlF٣
** مولکولهایی که اتم مرکزی آنها میتواند بیشتر از هشت الکترون لایهی ظرفیت داشته باشد، میتوانند پذیرندههای الکترون باشند و در طبقه بندی اسیدهای لوئیس قرار گیرند، مانند:
SiBr٤, SiF٤
** مولکولهایی که چندین پیوند بین دو اتم با الکترونگاتیوی متفاوت دارند، اسید لوئیس به شمار میروند، مانند:
CO٢, SO٢

چه موادی باز لوئیس هستند؟
بازهای لوئیس به دلیل آن که جفت الکترون های خود را می بخشند، هسته دوست نامیده می شوند؛ یعنی با جفت الکترون تنهای خود، بار مثبت را مورد هدف قرار می دهند. بازهای لوئیس بالاترین اوربیتال مولکولی اشغال شده (HOMO) را مورد استفاده قرار می دهند (شکل بالا).
** یک اتم، یون یا مولکول با یک جفت الکترون تنها میتواند باز لوئیس باشد. هر کدام از آنیون های زیر می توانند الکترون های خودشان را به یک اسید واگذار کنند:
OH-, CN-, CH٣COO-, :NH٣, H٢O:, CO:
HOMO و LUMO:
اسید و باز لوئیس؛ هر دو دارای اوربیتال های اشغال شده و خالی هستند؛ اما بالاترین اوربیتال مولکولی اشغال شده ی (HOMO) باز لوئیس با پایین ترین اوربیتال مولکولی اشغال نشده ی (LUMO) اسید لوئیس واکنش می دهد تا اوربیتال های مولکولی متصل به هم را تشکیل دهند.
اسیدهای لوئیس به دلیل آن که اوربیتال های خالی دارند، در تراز انرژی پایین تری هستند؛ ولی بازهای لوئیس به دلیل این که جفت الکترون تنها دارند، تراز انرژی بالاتری را اشغال می کنند.
ایرادات نظریهی اسید و باز لوئیس:
با اینکه این نظریه ایرادات نظریههای اسید و باز آرنیوس و برونستد- لوری را ندارد و واکنش اسیدها و بازها را به خوبی توجیه می کند، اما ایراداتی نیز دارد:
· این نظریه برای قدرت نسبی اسیدها و بازها نمی تواند دلیل موجهی بیاورد چون بر اساس یونش نیست.
· یک واکنش اسید و باز، واکنش انتقال الکترون است و باید کاملاً سریع باشد اما بسیاری از واکنش های اسید و باز به صورت کند روی می دهند.
برچسبها:















 آمار
وب سایت:
آمار
وب سایت:

