انواع اوربیتال هیبریدی
اوربیتال هیبریدی SP
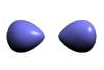

درگیر شدن تمام اوربیتال های پوسته والانس اتم مرکزی یک مولکول، در تشکیل اوربیتال های هیبریدی ضرورت ندارد. تنها آن تعداد از اوربیتال های مزبور برای تشکیل اوربیتال های هیبریدی مورد استفاده قرار میگیرند که تعداد پیوند لازم و نیز شکل هندسی مولکول را تأمین کنند. برای مثال توابع موجی سه اوربیتال هیبرید را میتوان از ترکیب ریاضی توابع موجی یک اوربیتال S و دو اوربیتال P به دست آورد. یکی از سه اوربیتال P، در این عمل شرکت نمیکند.
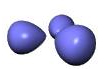
اوربیتال هیبریدی SP3
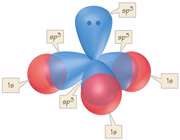
هیبریداسیونSP3 یک نوع مهم و متداول میباشد. این اوربیتالها از هیبرید شدن یک اوربیتال S و 3 اوربیتال P تشکیل میشوند.

اوربیتال هیبریدی SP3 با یک جفت الکترون غیر پیوندی: در مولکولهایی مانند NH3 میتوان تصور کرد که اتم نیتروژن از اوربیتالهای هیبریدی SP3 استفاده کرده است، که یکی از آن ها توسط یک جفت الکترون غیر مشترک اشغال شده است. اتمهای مولکول یک هرم مثلثی تشکیل میدهند. ولی آرایش 4 اوربیتال N تقریباً به صورت یک 4 وجهی است و زاویه پیوند تقریبا برابر با 107 درجه میباشد.
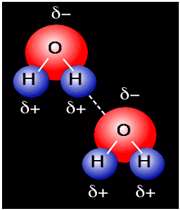
اوربیتال هیبریدی SP3 با دو جفت الکترون غیر پیوندی: اتم اکسیژن هم در مولکول H2O از اوربیتالهای SP3 استفاده میکند که در آن دو اوربیتال هیبریدی توسط دو جفت الکترون غیر مشترک اشغال شدهاند. زوایای اتم و 104/5 0 میباشد که این زاویه به 1090 نزدیک تر است تا به 900 ، که در صورت به کار رفتن اوربیتال خالصP، انتظار میرفت.
اوربیتال هیبریدی دارای اوربیتال d
اوربیتالهای d2SP3 : این اوربیتالها از هیبرید شدن 2 اوربیتال d و یک اوربیتال s و 3 اوربیتال p به وجود میآیند.
هر 6 اوربیتال با یکدیگر همارز بوده و به سوی گوشههای یک هشت وجهی منتظم جهت گیری دارند. یک نوع از این ها با یک جفت الکترون غیر پیوندی (این اوربیتال دارای شکل هرم، با قاعده مربع) بوده و نوع دیگرش با دو جفت الکترون غیر پیوندی (این اوربیتال دارای شکل مربع مسطح) میباشد.

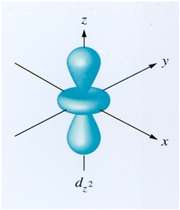
اوربیتال اتمی dx2 - y2: در تشکیل این اوربیتال هیبریدی دخالتی ندارد. پنج اوربیتال حاصل با یکدیگر همارز نیستند. این اوربیتالها در گوشههای یک دو هرمی مثلثی جای میگیرند. زاویه بین پیوندهایی که در قاعده قرار گرفتهاند 1200 و پیوندهای خارج از قاعده 900 و زاویهای که دو راس هرم را به هم وصل میکند 1800 میباشد.

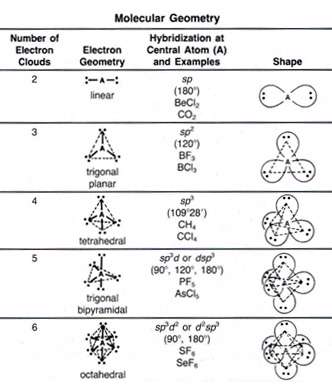
نکات مهم در هیبریداسیون اوربیتالها
• محاسبات نشان میدهد که استفاده از اوربیتالهای هیبریدی به تشکیل پیوندهای قوی تر منجر میشود.
• انرژی لازم برای ایجاد حالت برانگیخته و هم چنین انرژی لازم برای هیبرید شدن، بیش تر از انرژی آزاد شده به هنگام تشکیل دو پیوند نسبتا قوی کوالانسی است.
• اوربیتالهایی که در آن ها دو نوع معینی از هیبریداسیون به کار رفته است، باید از لحاظ انرژی نسبتا به هم نزدیک باشند.
• اوربیتالهایی که معمولاً در تشکیل پیوند به کار میروند اوربیتالهای d , p , s لایه خارجی و در برخی موارد اوربیتال d لایه ماقبل لایه خارجی هستند. به استثنای این اوربیتالهای d داخلی، الکترونهای اوربیتالهای داخلی معمولاً آن قدر به هسته وابسته هستند که نمیتوانند در تشکیل پیوند شرکت کنند.
مسابقه وبلاگ برتر ماه
نظرات شما عزیزان:
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:






 آمار
وب سایت:
آمار
وب سایت:

