تعادل 1

· تعادل چیست؟
· چگونه به سرعت میتوان به تعادل در یک واکنش شیمیایی رسید؟
· آیا دما روی تعادل و آهنگ واکنش تأثیر دارد؟
· ثابت تعادل چیست؟
· آیا تعادل روی مقدار محصولات واکنش (بازده) تأثیر دارد؟
در این مجموعه به تمامی سؤالات بالا پاسخ خواهیم داد. اما به راستی تعادل چیست؟ تعادل شیمیایی و تعادل فیزیکی چگونه حاصل میشوند؟
زمانی که یک واکنش شیمیایی شروع میشود، ابتدا واکنش دهندهها وارد عمل میشوند. رفته رفته از غلظت واکنش دهندهها کم شده و به غلظت محصولات اضافه میشود. در نهایت، زمانی میرسد که هیچ تغییری در غلظت واکنش دهندهها و محصولات مشاهده نمیشود. چنین واکنشهایی که در آنها فقط قسمتی از مقدار کلی واکنش دهندهها به محصول تبدیل میشود، فرایندهای برگشتپذیر نامیده میشوند.
تعادل زمانی است که:
- هر تغییری در طول واکنش برگشتپذیر است و میتواند با معادلهای که شامل یک فلش دوطرفه است، نشان داده شود.
- سیستم تعادلی، محصور و بسته است؛ سیستم بسته و محصور به سیستمی گفته میشود که هیچ مادهای نتواند وارد یا خارج این سیستم شود.
- در حالت تعادل، سیستم پویا است؛ گویی در مقیاس ماکروسکوپی به نظر میرسد هیچ اتفاقی نیفتاده است اما در مقیاس ریز، تغییرات برگشتپذیر به طور متوالی روی میدهند.
تعادل فیزیکی شامل تغییرات خواص شیمیایی مواد مرتبط با واکنش نیست. برای نمونه، تعادل بخار آب با خود آب در یک بطری در بستهی نیمه پر یک تعادل فیزیکی است زیرا مولکولهای آب فقط از مایع به بخار تبدیل میشوند.
تعادل شیمیایی با تغییر در ترکیب شیمیایی مواد، شکستن و تشکیل پیوند مرتبط است. یک مثال برای این تغییر، تجزیهی اسید استیک است. مبادلهی ذرات بین یونها و مولکولها در این تجزیه وجود دارد؛ زمانی که تعادل حاصل میشود، آهنگ مبادلهی ذرات بین یونها و مولکولها مساوی میشود.
مثال 1 از تعادل فیزیکی : تا مرحلهی 3، آهنگ تبخیر و آهنگ میعان کاملاً با هم متفاوتند و عمل تبخیر، بیشتر صورت میگیرد اما با گذشت زمان، میعان هم رو به افزایش است. در مرحلهی 3 و 4 آهنگ تبخیر و آهنگ میعان برای هر تغییر فیزیکی برابرند.
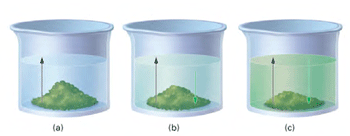 |
در حالت (c) آهنگ رفت (حل شدن مادهی جامد در حلال) و آهنگ برگشت (بلوری شدن مادهی حل شونده) در تعادل فیزیکیاند.

سؤال: در یک سیستم تعادلی، چه چیزهایی مساوی یا متعادل هستند؟
- لزومی ندارد غلظت مواد در تعادل، کاملاً مساوی باشد.
- فرایند هابر را به خاطر بسپارید (ساخت مواد خام و اولیه برای کود شیمیایی):

- در فشار و دمای اتاق، این واکنش تقریباً با هیچ NH3 در تعادل نیست.
- آهنگ تغییر در مسیر رفت واکنش (از چپ به راست معادله) با آهنگ برگشت (از راست به چپ) با هم مساویاند.
آهنگ واکنش
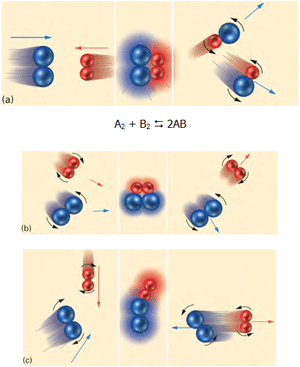
با استفاده از نظریهی برخورد در واکنشهای شیمیایی میتوان این مطلب را درک کرد. یک تغییر شیمیایی که به طور ماکروسکوپی قابل مشاهده است، نتیجهی تعداد زیادی از برخوردها مابین ذرات واکنش دهنده است. در شکل زیر و در حالت a، مولکولهای آبی و قرمز به دلیل اینکه انرژی جنبشی کافی و جهت مناسب دارند، واکنش انجام میگیرد. در حالت b با اینکه مولکولها جهت مناسب دارند ولی انرژی جنبشی کافی ندارند، واکنش انجام نمیگیرد. در حالت c مولکولها در برخورد با هم انرژی جنبشی کافی دارند اما جهتگیری آنها مناسب نیست؛ پس در این حالت نیز واکنش انجام نمیگیرد.
حال ببینیم تغییرات انرژی در طول واکنش به چه صورت است:
انرژی لازم برای واکنش (ΔE ) است. برای تشکیل محصولات، بایستی کمپلکسی از مجموعه ذرات فعال در واکنش با انرژی بالا نیز تشکیل شود. کمپلکس فعال شده، نوعی حالت واسطهی مولکولی است که در حین برهمکنش (برخورد) مولکولهای در حال واکنش با یک تغییر شیمیایی تشکیل میشود؛ بالاترین مقدار انرژی در حین واکنش به این حالت اختصاص دارد.
انرژی فعال سازی (Ea) کمترین انرژی جنبشی لازم برای تولید انرژی برخورد مؤثر است و با این انرژی میتوان به بالای تپه رفت!!!
در مطلب بعدی، این موضوع شرح داده خواهد شد.
مسابقه وبلاگ برتر ماه
نظرات شما عزیزان:
برچسبها:






 آمار
وب سایت:
آمار
وب سایت:

